研究者の方へ

千葉大学大学院医学研究院
アレルギー・臨床免疫学
千葉大学病院
アレルギー・膠原病内科

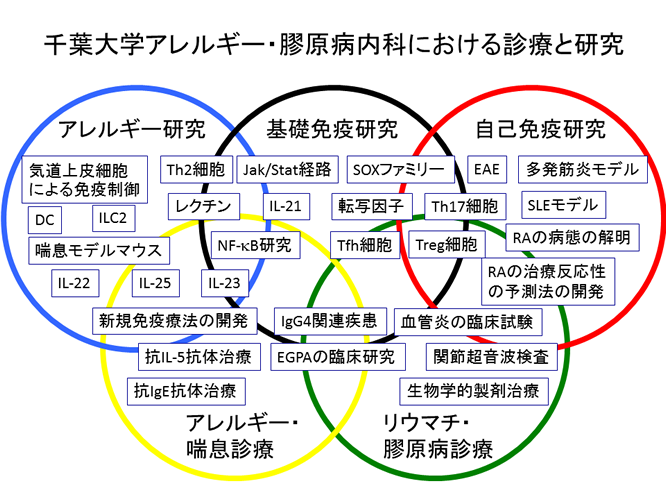
アレルギー・臨床免疫学では、アレルギー疾患や自己免疫疾患の基礎研究と臨床研究を行っています。「すぐに」とまでは言いませんが、遠からず臨床に役立つ可能性のある研究に重点を置いています。喘息の発症機構に関する研究、T細胞分化に関する研究、自己免疫疾患の病態制御に関する研究、リウマチ性疾患の画像診断に関する研究が主な研究テーマです。個々のメンバーの興味をできるだけ尊重しつつ、それぞれの研究が有機的に結びつくように心掛けています。
将来的には、1)アレルギー疾患の本質である非侵襲的抗原(アレルゲン)に対して過剰な免疫応答が惹起される分子機構の解明とその制御法の開発、2)自己抗原に対する免疫応答機構の解明とそれに基づく自己免疫疾患の治療法の開発を行ないたいと考えています。研究という禁断の果実を一緒に味わいませんか?
喘息患者の約10%を占める難治性喘息にはこれらのTh2細胞、Th2サイトカインを標的とした治療方法の効果が乏しく、異なる病態が関与していることが示唆されていました。我々の研究室では難治性喘息患者の気道で好中球性炎症が惹起されていること、さらには気道でのIL-17産生が喘息の重症度と相関することに着目し、Th17細胞がTh2細胞依存的に惹起されるアレルギー性炎症を増悪させることを示しました(Wakashin, Am J Respir Crit Care Care Med 2008)。また、このTh17細胞分化の分子機構に関して、肺のCD11b陽性樹状細胞に発現するDectin-2が必須であることを見出しています(Norimoto, Am J Respir Cell Mol Biol 2014)。このようにDectin-2/Th17経路が喘息の増悪に関わることを示す一方、喘息の抑制系にも着目しIL-22が気道上皮細胞からのIL-25産生を抑制することによりアレルギー性気道炎症を制御していることを示しています(Takahashi, J Allergy Clin Immunol 2011)
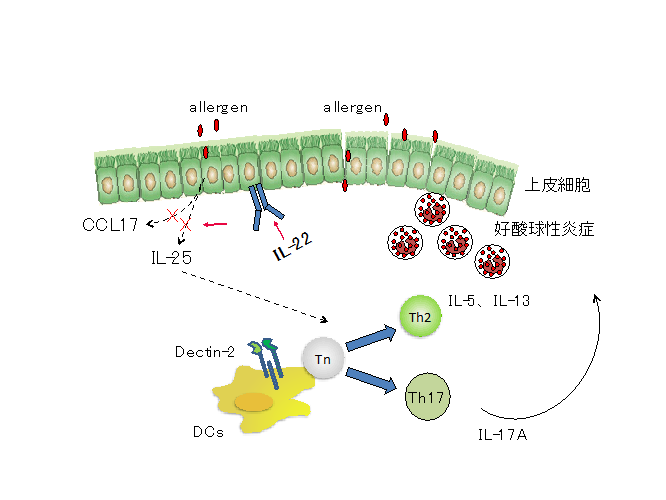
気道上皮細胞は、物理的バリアとして機能するだけでなく、アレルゲン、ウイルス、大気汚染物質等の外界からの様々な刺激に応答して種々のケモカインやサイトカインを分泌することで、樹状細胞や2型ヘルパーT(Th2)細胞だけでなく2型自然リンパ球(ILC2)を活性化し、喘息の病態において重要な役割を果たしていることが明らかにされています。気管支喘息の治療では、従来の吸入ステロイドに加え、IgEやTh2サイトカインをターゲットにした生物学的製剤が使えるようになりましたが、依然として数%の患者は治療抵抗性の難治性喘息です。
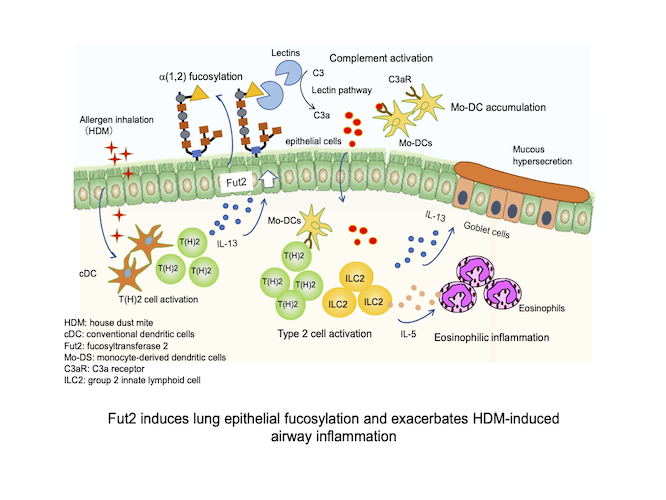
私たちは難治性喘息の克服を目指し、アレルギー性気道炎症における気道上皮細胞の役割に着目して研究を行なっています。最近の成果として、IL-22が気道上皮におけるReg3γ(抗菌ペプチドの一種)産生を誘導し、サイトカイン産生の抑制を介してアレルギー性炎症の進展を抑制すること(Ito T et al., J Exp Med 2017)、フコース転移酵素のFut2が気道上皮のフコシル化を誘導し、補体の活性化と樹状細胞(DC)の集積により気道炎症が悪化すること(Saku A et al., J Allergy Clin Immunol 2019、Allergy 2020)を明らかにしました(図)。
引き続き、気道上皮細胞と免疫細胞とのクロストークに着目し、新たな治療ターゲットを開拓することを目標としています。
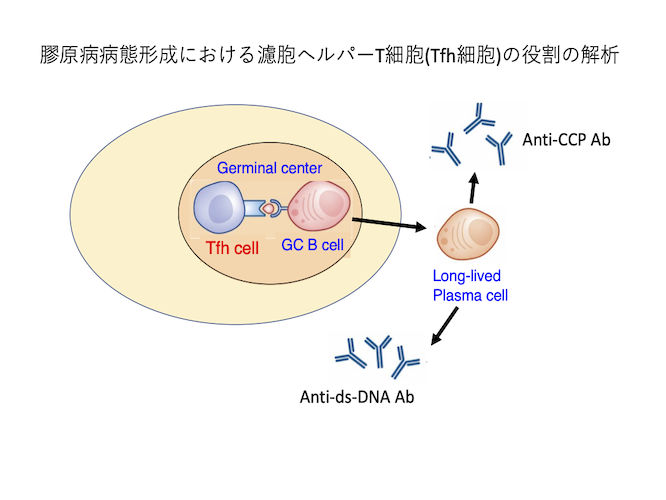
近年、高親和性抗体産生に重要な新たなCD4陽性T細胞サブセット濾胞ヘルパーT細胞(Tfh細胞)が、関節リウマチ(RA)や全身性エリテマトーデス(SLE)の発症に重要な役割を果たしていることが示唆されているが、その詳細については依然不明である。我々はこれまで、RA患者末梢血中のCD4陽性T細胞の網羅的遺伝子解析により、RA患者T細胞ではBCL3の発現が上昇していることを見出し、BCL3がTfh細胞分化を促進することによりRAの発症に重要な役割を果たしていることを見出している(Arthritis Rheumatol 2015 10:2651. )。現在、遺伝子改変マウスを用いたマウスRAモデルやループスモデルの解析を行い、膠原病病態形成におけるTfh細胞の役割の解析を行っている。
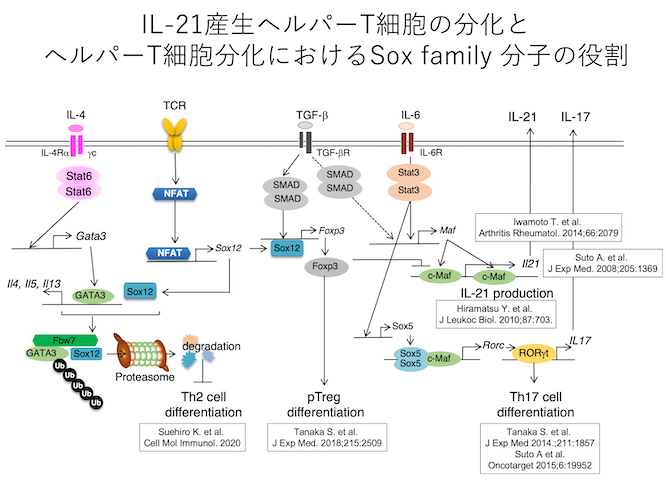
自己免疫疾患の病態には、転写因子RORγtを発現しIL-17やIL-21を産生することにより病態の惹起に寄与するTh17細胞とそれを抑制する制御性T細胞が深く関与する。本研究室ではIL-21受容体Fcキメラを用いたIL-21細胞内染色法を確立し、IL-6がヘルパーT細胞(Th細胞)からのIL-21産生を誘導することを見いだした (Suto A. et al. J Exp Med. 2008;205:1369)。さらにIL-21産生Th細胞の遺伝子発現の網羅的解析をおこない、転写因子c-MafがIL-21のプロモーター及びエンハンサーに結合することにより、IL-21の産生を誘導することを明らかにした(Hiramatsu et al. J Leukoc Biol. 2010;87:703.)。そしてFoxp3変異により制御性T細胞を欠損するScurfyマウスではIL-21産生c-Maf陽性T細胞が増加し、エフェクターCD8陽性T細胞により自己免疫性肺障害が惹起されることを明らかにした(Iwamoto T et al. Arthritis Rheumatol. 2014;66:2079)。
一方、Th17細胞の分化にはIL-6またはIL-21により誘導されるSTAT3の活性化とそれより誘導されるRORγtの発現が必須であることが示されていたが、STAT3の下流でRORγtの発現を誘導する分子機構の詳細は不明であった。本研究室ではSoxDファミリーに属する転写因子Sox5とc-MafがRORγtプロモーターの近接した部位に協調的に作用することによりRORγtの発現を増強しTh17細胞の分化を誘導することを明らかにした (Tanaka S. et al. J Exp Med 2014.;211:1857-74, Suto A. et al. Oncotarget. 2015;6:19952-3.)。
更に、CD4陽性T細胞のSoxファミリー分子の発現を検討し、腸炎を惹起したマウスの制御性T細胞で健常マウスの制御性T細胞と比較してSoxCファミリーに属するSox12が特異的に発現していることを見出した。そしてSox12がT細胞受容体刺激後NFATにより発現誘導され、Foxp3のプロモーター領域に結合しFoxp3の発現を誘導し、末梢誘導性制御性T細胞分化に関わっていることを明らかにした (Tanaka S et al. J Exp Med. 2018;215:2509)。
一方、Sox12はTCR-NFATにより誘導されることより、炎症部位に存在するTh細胞においても何らかの役割を果たしていることが示唆された。実際、チリダニ誘発性喘息を惹起したマウスの肺のTh細胞では縦隔リンパ節の細胞と比較してSox12の発現が有意に高かったため、Th2細胞分化におけるSox12の役割を検討した。その結果、Sox12はTh2細胞のマスター転写因子であるGATA3と結合しプロテアソームによる分解を促進し、Th2細胞分化を抑制することを明らかにした(Suehiro K et al. Cell Mol Immunol. 2020)。
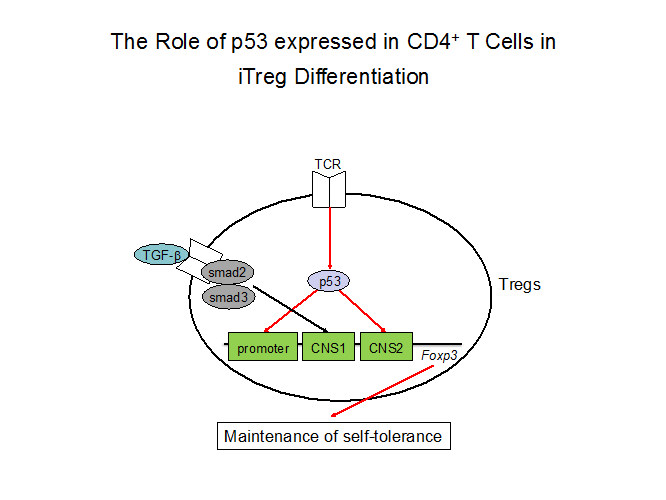
近年、腫瘍抑制因子p53が、全身性エリテマトーデスなどの全身性自己免疫疾患の発症制御に関与するとの報告があるが、そのメカニズムは未だ不明のままです。我々はこれまで、我々はCD4+ T細胞特異的にp53を欠損したマウス(p53-cKOマウス)を解析し、p53-cKOマウスでは全身性自己免疫疾患が自然発症すること、またp53の発現が末梢性の制御性T細胞(Treg)の分化に重要であることを明らかにしました(Takatori, J Immunol 2013)。
現在、ヒトのCD4+ T細胞に発現するp53がどのような役割を果たしているのかについての検討を開始し、関節リウマチ等の自己免疫疾患の詳細な発症制御機構を今後解明して参ります。
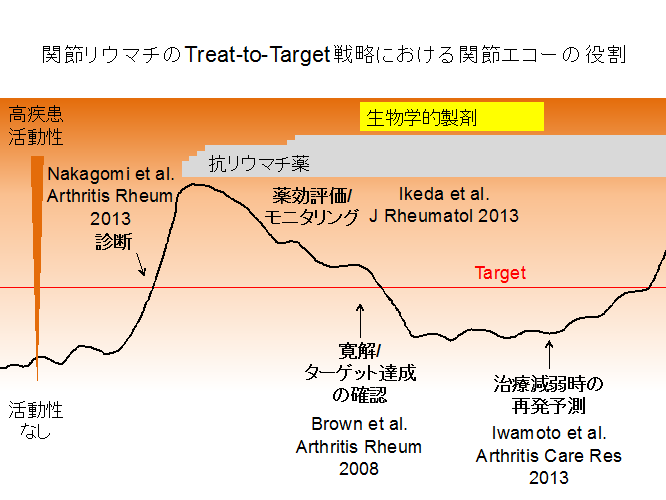
私たちは、如何に画像診断がリウマチ性疾患および膠原病の診療を向上させることができるかを研究しています。特に関節リウマチでは、従来の診察、血清所見を中心とした評価では、関節破壊を完全に抑える正確な評価は難しいとされており、関節エコー検査により関節リウマチの正確な診断(Nakagomi, Arthritis Rheum 2013)、疾患活動性モニタリング(Ikeda, J Rheumatol 2013)、寛解評価(Brown, Arthritis Rheum 2008)、ならびに生物学的製剤中止後の再発予測が可能であること(Iwamoto, Arthritis Care Res, in press)を示してきました(図1)。また、実際に関節エコー所見をガイドとした関節リウマチの治療戦略の有効性を示す臨床試験が現在進行中であり(Wakefield, Ann Rheum Dis 2012)、更に関節エコーの活用、標準化(Ikeda, Arthritis Rheum 2013, Ikeda, Mod Rheumatol 2013)につき多くの検討を行っています。また私たちは、関節リウマチだけではなく乾癬性関節炎(Bakewell, J Rheumatol 2013)や自己炎症性疾患(Ikeda, J Pediatr 2013)における関節エコーの活用、また多発性筋炎/皮膚筋炎における18FDG-PETの有用性(Tanaka, Rheumatology 2013)等、広い疾患、画像モダリティーにつき検討を行っています。
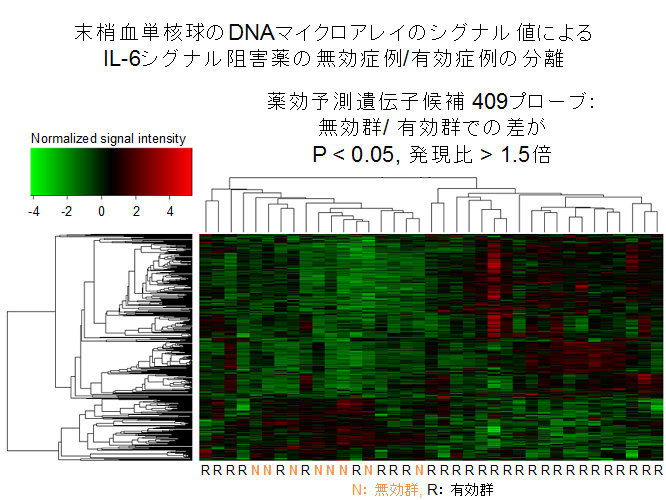
私たちは、関節リウマチ患者さんの末梢血単核球における遺伝子発現を、ゲノムワイドDNAアレイで網羅的に解析し、最適な薬剤選択、ならびに治療ターゲット特異的な薬効評価に役立つバイオマーカー(図2)、さらには新規治療ターゲットの同定を行っています。それによりインターロイキン6(IL-6)シグナル阻害薬の有効性予測にI型インターフェロン誘導遺伝子およびメタロチオネインの発現解析が有用であることを見出し(Sanayama, Arthritis Rheumatol 2014)、またIL-6の下流でARID5AがTh17細胞分化の制御因子として働いていること(Saito, Arthritis Rheum 2013)、IL-6の下流でBcl-3が濾胞性ヘルパーT細胞分化を介して関節リウマチの病態に関わっている可能性があること(Meguro, Arthritis Rheum 2015)、さらにIL-6によりHelios発現が抑制され、それにより抑制性T細胞機能が阻害され得ること(Takatori, Arthritis Rheum 2015)を見出しました。多くの抗リウマチ薬、特に生物学的製剤につき同様の手法で解析を行っており、個々の患者さんに最適なテイラーメイド医療の実現を目指しています。
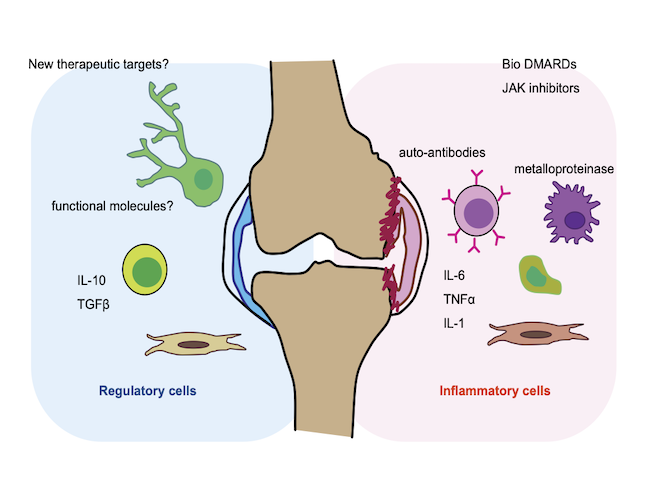
関節リウマチは原因不明の慢性関節炎です。関節リウマチの病態については主に炎症を惹起するメカニズムについて活発に研究が行われてきました。その成果として炎症性サイトカインをターゲットとした生物学的製剤や小分子化合物が開発され、文字通り関節リウマチ治療の”ゲームチェンジャー”となりました。しかし、これら新しい抗炎症治療によっても寛解に至らない症例も少なくないため、新たな治療戦略の構築が求められています。
私達は、関節炎症を沈静化し、関節機能を保護する生体機能があり、関節リウマチ患者においてはこの機能が破綻していることで炎症が慢性化していると考え、マウス関節炎モデルや関節疾患患者の滑膜検体を用いて研究を行っています。
その他、組織に定着している制御性T細胞についての研究にも興味を持っています(Tanaka et al., J Exp Med. 2019)。
気管支喘息は最も頻度の高いアレルギー性呼吸器疾患であり、その本態はTH2細胞/TH2サイトカインが惹起する慢性アレルギー性気道炎症となります。近年、TH2サイトカインの上流・下流の探索により上皮細胞、自然免疫細胞、樹状細胞などの活性化とそれらの産生するサイトカインもアレルギー性炎症に重要であることが明らかとなりました。しかし5-10%の患者では既存の治療ではコントロール不十分な難治性の経過をたどり生命を脅かす状態に至ること、抗体医薬による各種サイトカイン阻害療法が開発・一部臨床応用されておりますが、効果は依然限定的であること、そして根治療法が存在しないこと、からさらなる病態解明が必要とされています。そこで、私たちはアレルギー性気道炎症の詳細な病態解明を達成するため、気管支喘息において重要と知られている細胞たち、上皮細胞/自然免疫細胞/樹状細胞/T細胞/好酸球の網羅的な遺伝子発現解析、ゲノム活性化領域の同定、重要因子を抽出するといわれているスーパーエンハンサー解析を経時的・網羅的に行うことで、各種細胞の未知の重要な因子の抽出と、各種細胞間の相互作用を解明し、新たな病態の理解に基づく創薬基盤を確立するとともに、難治性喘息の治療ターゲットのシーズ探索を行っております。これまで数百の気管支喘息関連スーパーエンハンサー/スーパーエンハンサー関連遺伝子を同定いたしました。現在これらの機能解析と相互作用の同定を行っております。

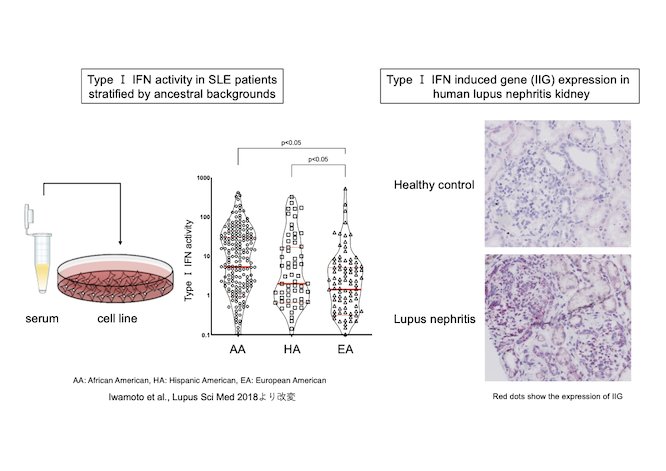
全身性エリテマトーデス(SLE)は、自己抗体産生と免疫複合体の組織沈着による全身の臓器障害を特徴とする予後不良の全身性自己免疫疾患です。SLEの発症及び病態形成にI型インターフェロン (IFN) が深く関与していることが示唆されており、IFN受容体抗体であるanifrolumabも臨床試験において一定の効果を示していますが、その詳細な作用機序は不明です。
SLEはまた、人種的背景によってもIFN産生能及び臨床病型、自己抗体フェノタイプ、重症度が大きく異なることもわかっています (Iwamoto et al., Lupus Sci Med. 2018)。
私達は日本人SLE患者の発症及び病態形成におけるIFNの役割を明らかにすベく、SLEマウスモデルやSLE患者検体を用いた研究を行っています。
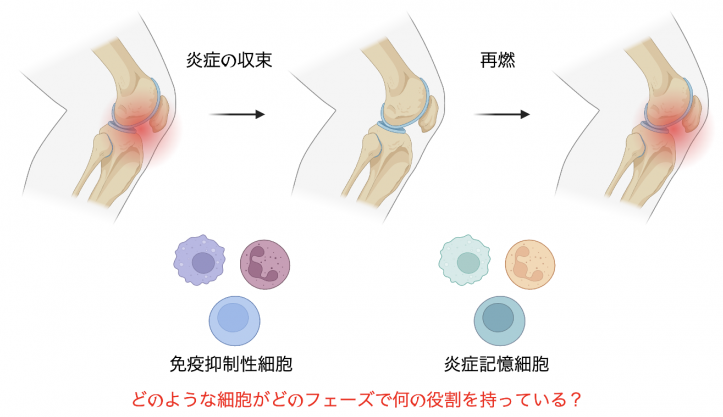
関節リウマチは原因不明の慢性関節炎です。その病態解析は炎症が生じるメカニズムに関する研究を中心に活発に行われてきました。その成果として炎症性サイトカイン等をターゲットとした生物学的製剤やJAK阻害薬(b/tsDMARDs)が開発され、文字通りゲームチェンジャーとなりました。我々もこれまでリウマチの悪化に関わる因子について解析を行ってきました(Shoda et al., Arthritis Res Ther. 2022, Etori et al., Rheumatology. 2023, Suga et al., JCI insight. 2023)。しかし、b/tsDMARDsを使用中にもかかわらず再燃を繰り返す症例を経験するため、新たな着眼点に基づく治療戦略が必要と言えます。
現在、関節炎症の収束および再燃というフェーズに着目し、そこでの細胞分子機構を解明することによる新規治療の基盤開発を志しています。
その他、組織に在住する制御性T細胞についての研究にも興味を持っています(Tanaka et al., J Exp Med. 2019, Kasuya et al., Sci Rep. 2023)。
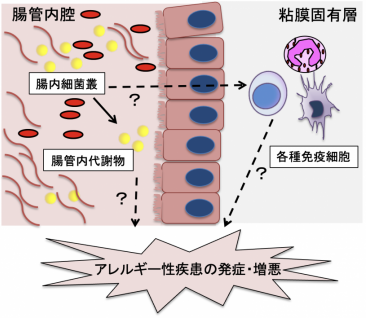
ヒトを含め動物の腸内には100兆個に及ぶ細菌が生息しており、これらの一群を腸内細菌叢と呼ばれています。腸内細菌叢や腸内細菌叢が産生する腸管内代謝物は以前より炎症性腸疾患、関節リウマチなどの自己免疫疾患、糖尿病・高血圧などの生活習慣病との関連が指摘されております。アレルギー性疾患においても代表的な腸管内代謝物の一種であるプロピオン酸およびGPR41陽性好酸球がアレルギー性気道炎症を抑制するメカニズムが報告されております(Ito et al., Gut microbe. 2023)。
私達は腸内環境(腸内細菌叢・腸管内代謝物)がアレルギー性疾患の発症・増悪に寄与するメカニズムの解明を目指しています。