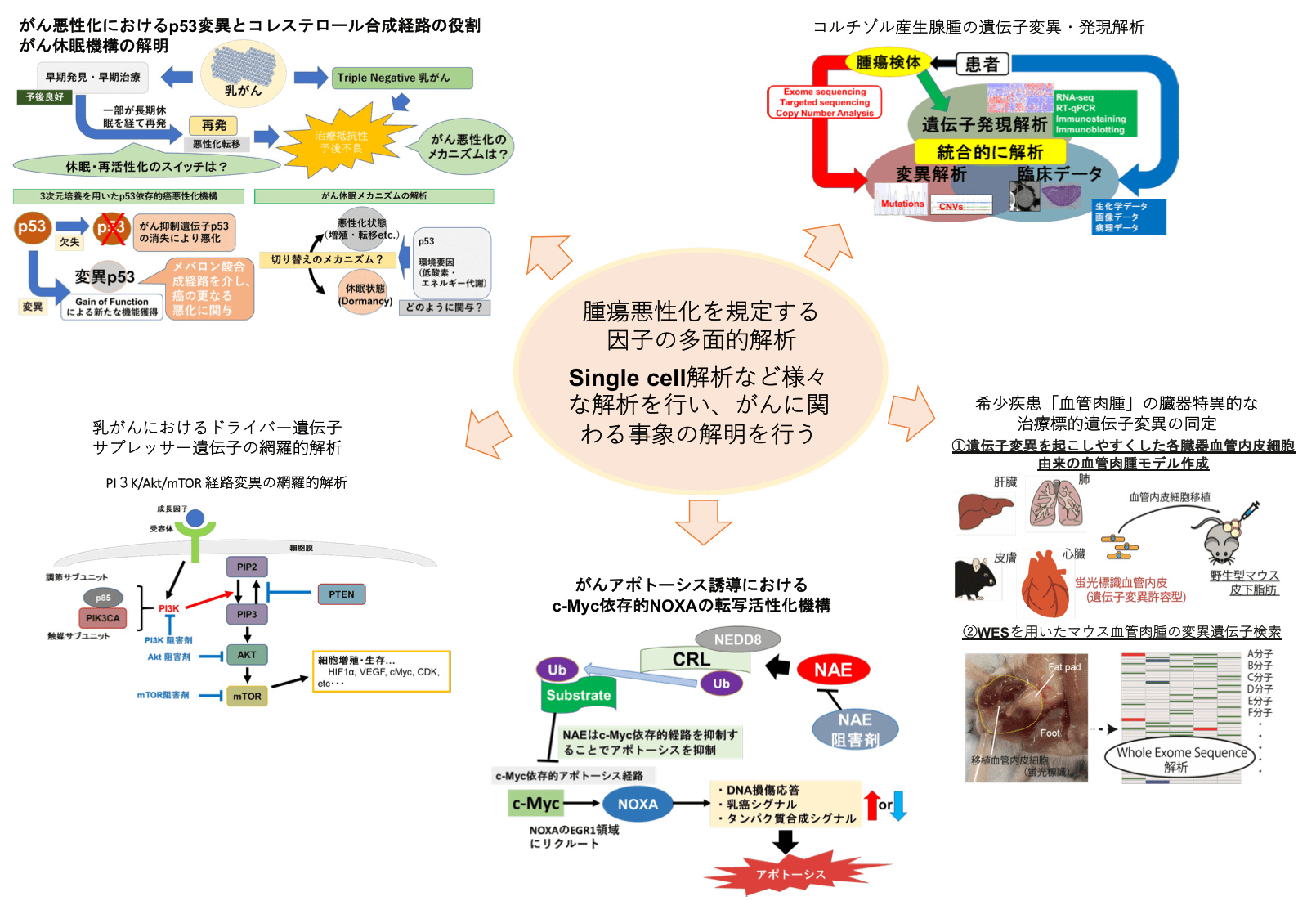
がんの運命決定は、生体からの排除機構に対して幾重にもなる適応能力を獲得することによってなされる。最近急速に進歩の見られている腫瘍免疫をはじめ腫瘍細胞の代謝機能制御・細胞死プログラムからの回避など、解明された事象は数多くある。しかしその全体像をつかむことは非常に困難であり、各細胞で起こっている分子制御、特にエピジェネティックスまで含めた転写調節は複雑に絡み合っている。当研究室では、Single cell解析を用いた統合的・時間的な網羅的解析から、がんに関わる事象をひとつひとつ解き明かしたいと考えている。
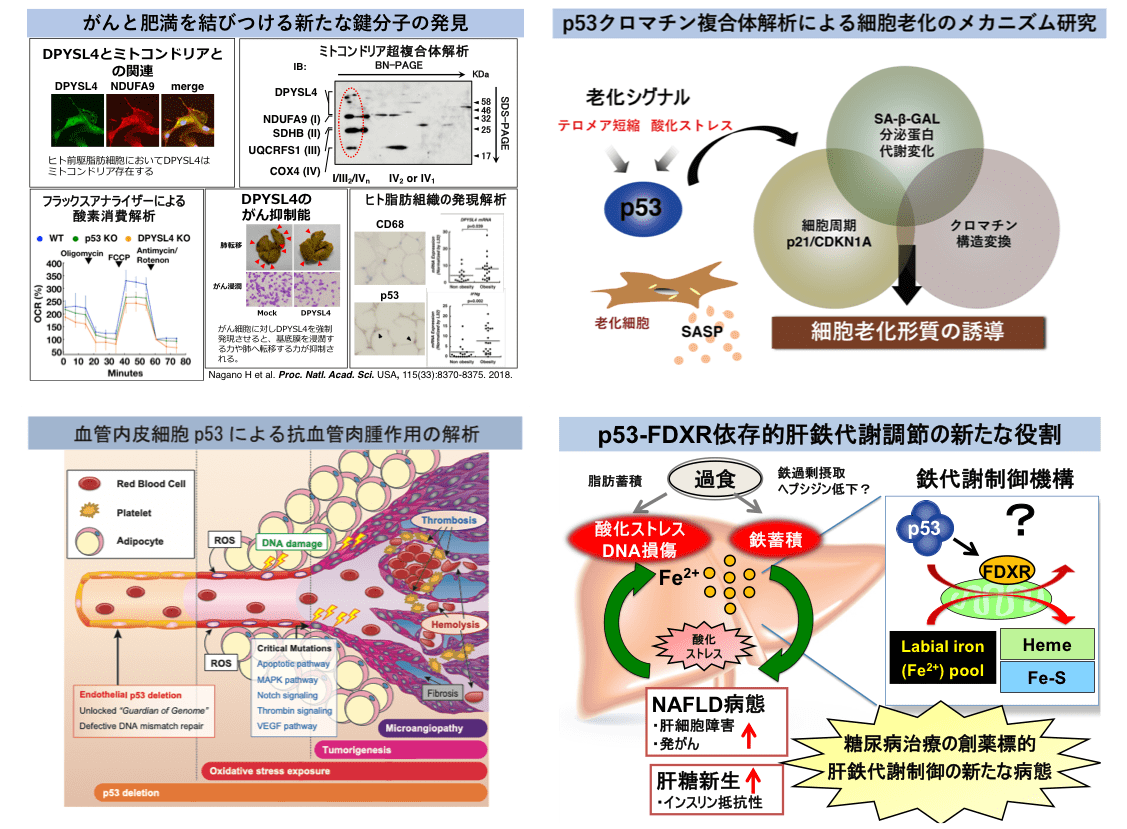
細胞をがん化から守り、遺伝子への傷害をいち早く感知する分子としてp53は幅広く研究されてきた。しかし、すでにその発見から40年あまりが経過したが、その機能はまだまだ未知の事象にあふれている。その最大の理由として、同分子の制御はがんに留まらず生活習慣病・加齢老化・生存分化に至るまで多岐に渡ること、さらに相互作用を起こす分子がダイナミックに変動していることにある。その中で私たちは、p53と協調的に果たす複合体分子として、転写ターゲット決定に関与するhCAS/CSE1Lやグルタミン代謝を司るGLS2、ミトコンドリア呼吸に関わるDPYSL4などを発見してきた。最近ではp53 を介した肝臓鉄代謝に関わる分子の制御やp53依存性に細胞老化を果たす分子の解明も終えようとしている。
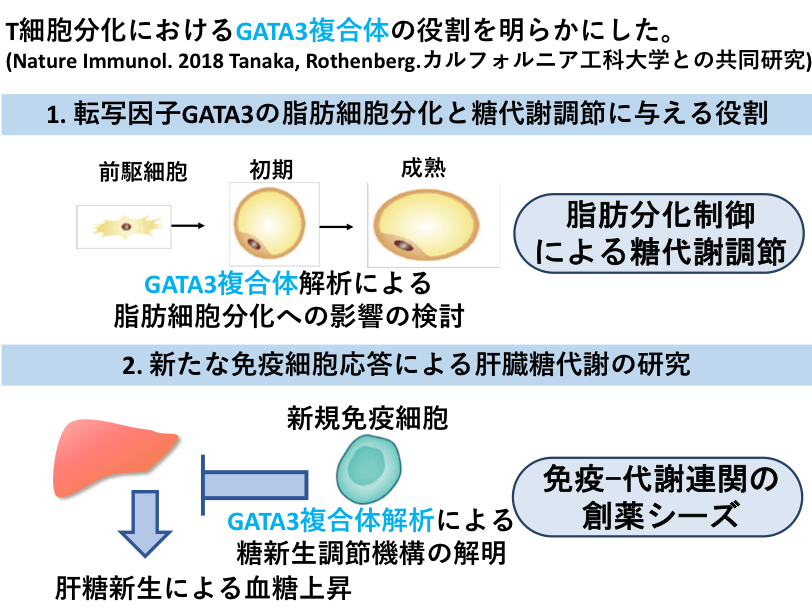
今や現代病の典型とも言える2型糖尿病は、膵臓におけるインスリン分泌という捉え方ではなく、前駆状態からはじまるインスリン抵抗性と肝臓での糖新生という全身での病態把握から治療を行う時代となっている。なかでも早期からインスリン抵抗性に関わるサイトカインを産生する脂肪細胞は、肥満と密接に関わりその成熟化制御に多くの研究がなされている。 また肝臓における糖新生は、心血管イベントとも相関が高い空腹時高血糖に重要な役割を果たし、FoxO1などの転写因子の関与が知られている。しかし、肝臓は肝細胞以外に多種にわたる細胞が集簇しているものの、それらの糖新生への役割はほとんど明らかにされていない。私たちは、これらの現状に対して、転写因子GATA3がその複合体と協調してコントロールする分子制御について、白色脂肪細胞・肝臓免疫細胞において研究している。
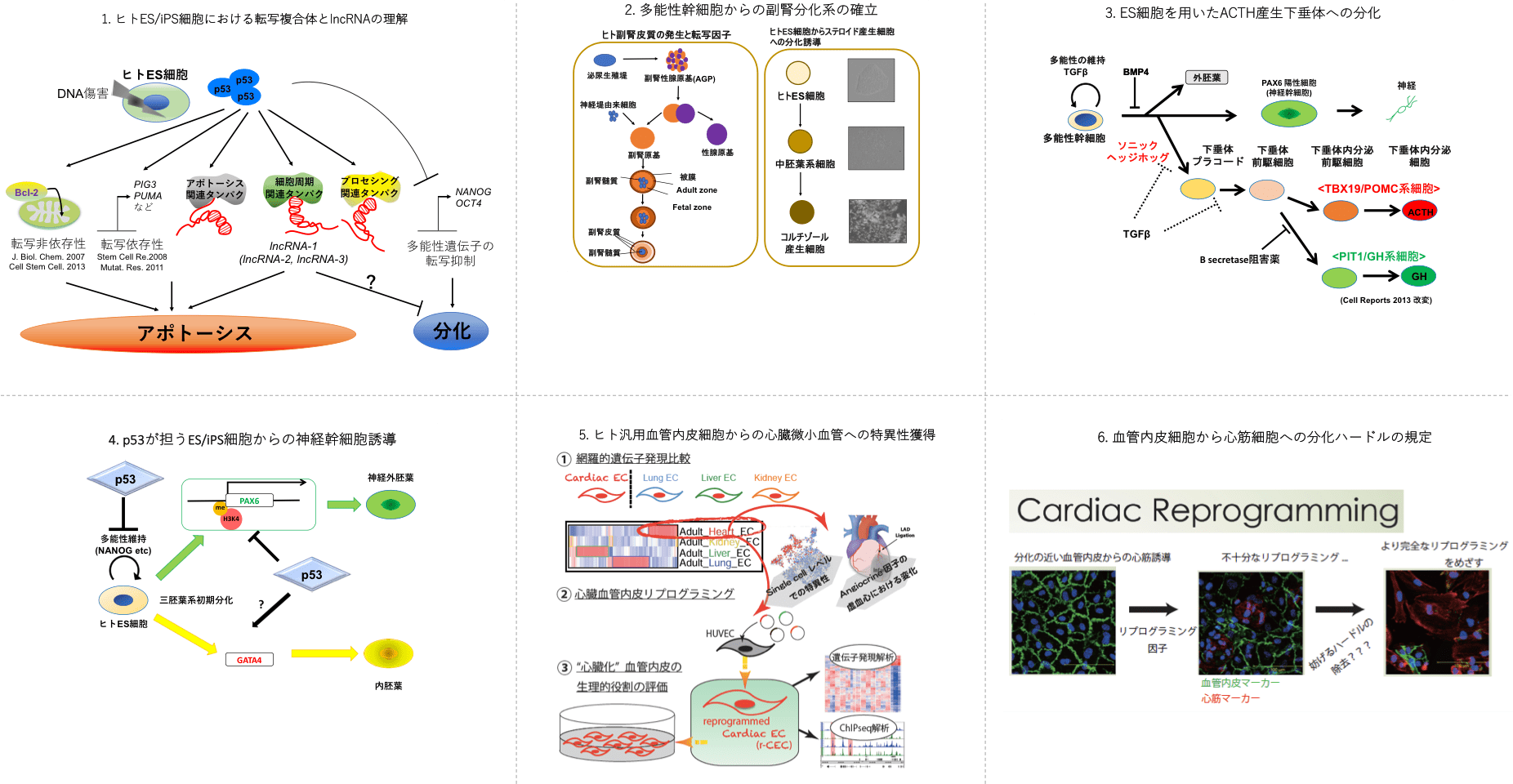
ヒトへの臨床応用も始まった多能性幹細胞研究は、分子レベルでの制御研究と実応用とが同時に進行しており、長期的な臨床予測が幅広く別れる挑戦的分野と私たちは捉えている。周知のように、分化のメカニズム・実質細胞との相違・安全性の担保など、解決すべき研究課題は山ほどある。その中で、多くの研究が転写因子調節から始まるカスケードに注力する中、私たちはnon coding RNAがどのように未分化維持に関わるか研究している。p53は多能性クローン作成に抑制的に働くことが知られていることから、p53依存性に働く新規のlncRNA探索に成功し、その機能解析を進めている。また、臓器によっては分化系が比較的確立しているが、ホルモン産生を担う内分泌臓器の作成はまだ十分とは言えない。さらには、がん化のリスクが完全に排除できない多能性を回避できるダイレクトリプログラミングによる技術革新にも分子学的に貢献を試みている。
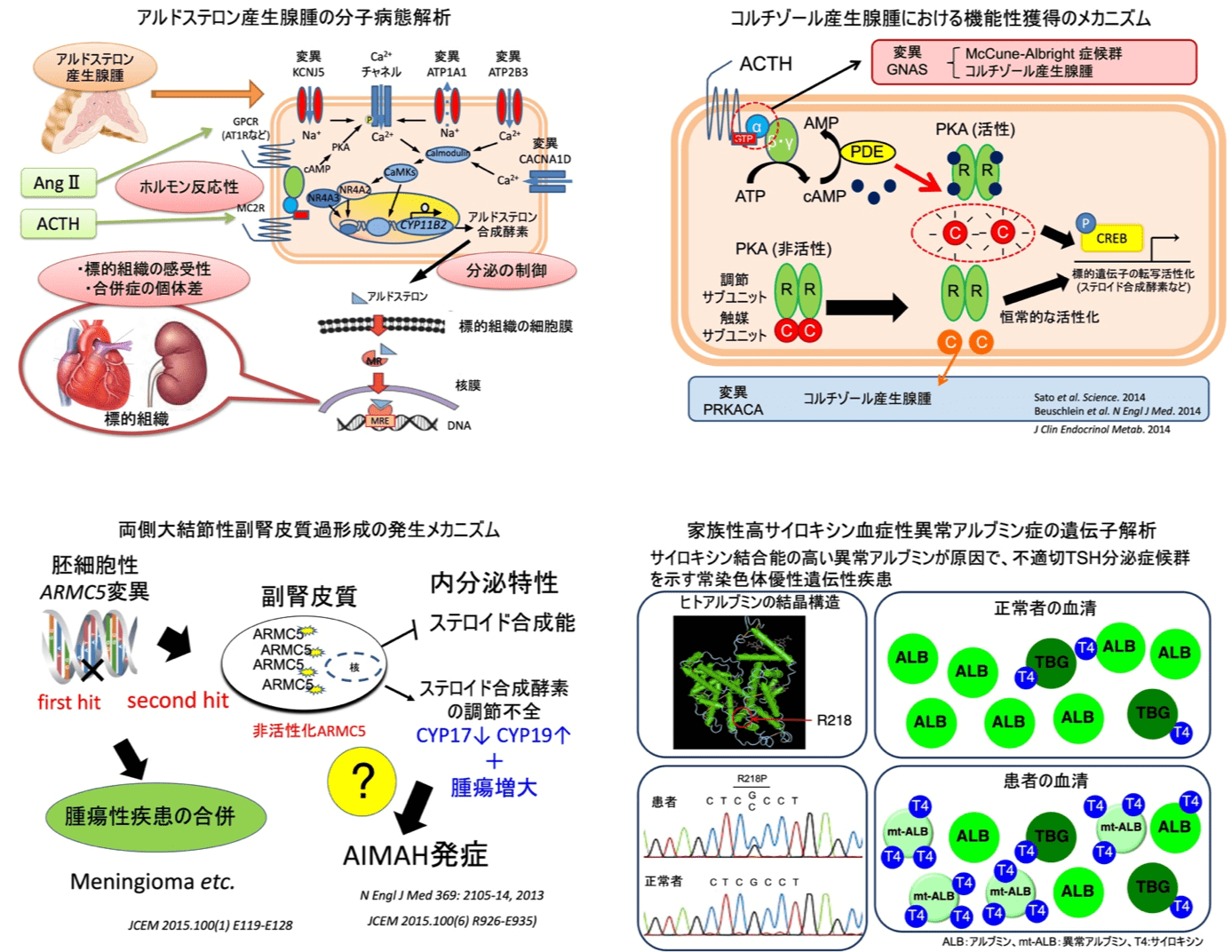
内分泌とは、脳の視床下部・下垂体ホルモンを司令塔として、甲状腺ホルモン、副腎皮質ホルモン、性腺ホルモンなどの化学物質を血管中へ放出することであり、それによって生体の恒常性と生命の維持がなされる。ひとたびこの制御に異常が起こると、個体は様々な疾患を発症する。内分泌腫瘍では、内分泌細胞が腫瘍化するだけでなく、他のホルモン制御を逸脱して「ホルモン自律分泌」を獲得することが生体にとって悪影響を及ぼす。遺伝性内分泌疾患では、単一・複数の過形成病変と機能的な異常を呈したり、生体での表現系と実際の臨床検体における検査値異常の乖離を引き起こすような症候群まで様々である。私たちは、ゲノミクス・トランスクリプトミクス・プロテオミクス・メタボロミクスという多階層情報を統合して捉えることで、内分泌腫瘍・遺伝性内分泌疾患の腫瘍化とホルモン自律分泌異常のメカニズムを解明する。