研究テーマ

千葉大学大学院医学研究院
呼吸器病態外科学
千葉大学病院
呼吸器外科

肺再生医療の実現を目指して
平成19年に吉野教授が当教室に着任してから、われわれは肺再生医療の実現を目指し、特に術後肺に着目し、肺切除後の残存肺における肺胞組織の再生・修復を目的とした基礎研究に着手しました。
一般的に、成熟した個体において肺は再生しない臓器として知られており、多くの臓器で再生医療が現実化しつつある昨今でも、肺をターゲットとした肺再生医療の実現は非常に難しいと考えられております。しかしながら、げっ歯類(マウス・ラット)や犬を用いた動物実験においては、ある一定量の肺を切除した場合、残った肺が切除肺を補うようにして成長する現象が1800年代から報告されており、「代償性肺成長」として知られています[1]。また、羊や豚においては、子羊や仔豚に、成熟した大人の肺を移植した場合、体の成長とともに移植肺も成長することが報告されております[2,3]。このように、成熟した個体においても、ある特殊な環境が整っていれば、既存の肺組織が成長する可能性は十分に秘めているのです。
一方で、近年の幹細胞研究の発展とともに、肺における幹細胞についての報告も飛躍的に増加しています。主にマウスを用いた研究で、肺の修復や成長に携わる体性幹細胞が肺の各領域に存在することが示唆されており、具体的には、気管上皮における基底細胞[4]、細気管支におけるクララ細胞[5]、細気管支肺胞境界領域のBronchioalveolar stem cells (BASCs) [6]、肺胞領域のII型肺胞上皮細胞[7]が幹細胞の役割を担うと考えられています。さらに、肺胞領域の体性幹細胞と考えられているII型肺胞上皮細胞を分離し[8]、またはヒト胚性幹細胞(ヒトES細胞)から分化させ[9]、経気道的に投与することで傷害肺が修復・再生することが報告され、幹細胞を用いた肺再生医療の可能性が示唆されました。最近では、ヒト切除肺から、自己複製能、細胞増殖能かつ多分化能を持つHuman lung stem cellsが同定・分離され、免疫不全マウスの傷害肺に局所注射することで、傷害肺の再生に寄与することが報告されました[10]。
このように、肺の成長・修復・再生メカニズムは動物モデルにおいて存在し、さらにヒトにおいても肺における幹細胞が同定され、その知見が集積しつつあります。そしていまや幹細胞を用いた肺再生医療は、近未来の実現可能な新たな治療法と成りうるものであり、ヒトでの臨床応用へ向けて多くの施設で、日々、盛んに研究が行われています。
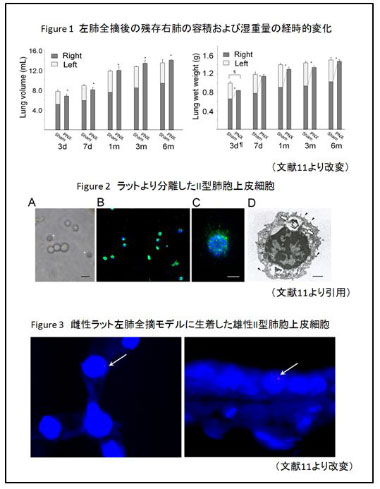
われわれは、これまで肺切除後の代償性肺成長と、肺胞領域の体性幹細胞の役割を担うII型肺胞上皮細胞に着目し研究を行ってきました。まず、左肺全摘後ラットの残存右肺における代償性肺成長を確認することから 始め、残存肺の容積・湿重量は失った分を補うように増加するものの、全摘後の残存肺の肺胞腔は拡大して、過膨張を呈していることを確認しました(Fig 1)。
さらに、マイクロアレイによる網羅的遺伝子解析から、肺の過膨張過程における血管・神経などの支持組織の増殖・リモデリングを示唆する所見のみ認め、肺胞の再生を示唆する所見は認めないことを示しました。次に、ラットから両肺を摘出し、消化酵素やろ過法、重層遠心分離法を用いてII型肺胞上皮細胞の分離を行いました。分離した細胞は、その多くが、SP-Cによる蛍光免疫染色、および電子顕微鏡所見からII型肺胞上皮細胞の特徴を有する細胞であることを確認しました(Fig 2)。さらに、分離したII型肺胞上皮細胞を全摘後の残存肺に経気道的に投与することで、投与した細胞が残存肺に生着し(Fig 3)、さらには投与後の肺胞腔が密になっていることから新たな肺胞組織の構築に寄与している可能性を報告しました[11]。
ノーベル生理学・医学賞を受賞された山中伸哉京都大学教授のiPS細胞をはじめとする再生医療は、今、最も注目されている分野の一つであり、社会からの期待も大きく、多くの可能性を秘めた分野です。われわれの研究はまだ始まったばかりであり、検証すべき問題点も多数残されておりますが、近未来における新たな肺再生医療の実現に向けて、少しでも貢献できるよう努めてまいります。
(文責:和田啓伸-トロント総合病院留学中)