
両側副腎皮質大結節性過形成 PMAHの病態解明
研究代表者 鈴木 佐和子 千葉大学 大学院医学研究院 助教
研究概略
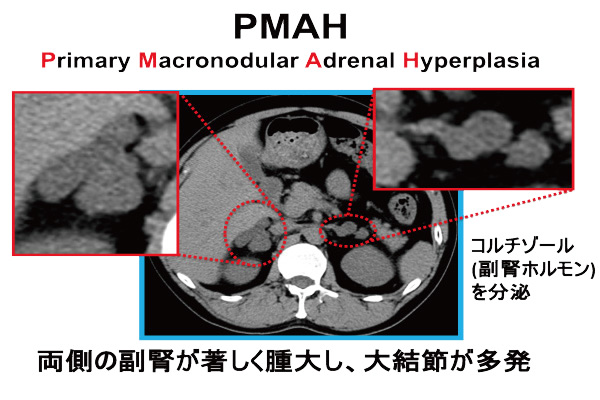
Primary Macronodular Adrenal Hyperplasia (PMAH)は両側副腎に1cmを超える大結節が多発する比較的稀な病気で、しばしばコルチゾールを過剰産生します。副腎皮質おけるバソプレッシン受容体、GIP受容体、β-アドレナリン容体などのG蛋白型共役型受容体が原因でACTH非依存的にコルチゾールを分泌することが病態の主因と考えられていました。
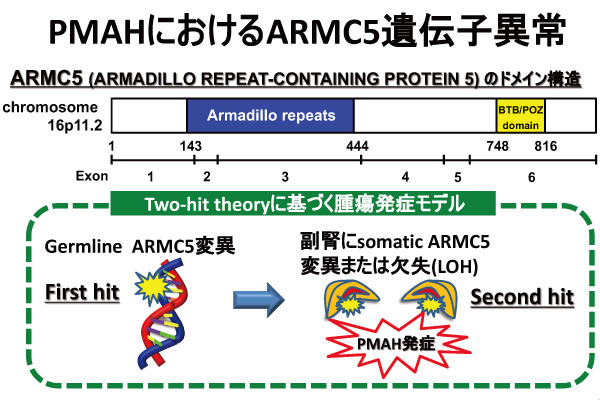
病名もACTH-independent macronodular adrenal hyperplasia (AIMAH)と呼ばれており、中でもバソプレッシン反応群が多く、コルチゾール自律産生能がそれほど高くないにも関わらず、高血圧や糖尿病を高率に合併し、加えて副腎外の様々な癌を合併することを我々は報告してきました。その後、副腎局所で産生されるACTHの存在が明らかとされPMAHへと改名され、2013年のPMAHにおけるARMC5遺伝子変異の発見の報告は、病因解明の大きな進歩でした。ARMC5は癌抑制遺伝子でありtwo-hit theoryに基づきPMAH結節を発症します。
我々のグループでは10年以上に渡りPMAHの臨床的特徴、whole exome sequenceを用いた網羅的遺伝子異常解析およびPMAH副腎腫瘍部におけるシグナル制御につき解析を行っており、現在は依然不明な点が多いARMC5遺伝子の副腎腫瘍発症メカニズム・ホルモン分泌制御メカニズムにつき検討をすすめています。
PMAHとは?
PMAHの病因としてのARMC5遺伝子異常の同定
本研究の展望 / 臨床応用に向けて
鈴木 佐和子(研究代表者)
PMAHはコルチゾール過剰分泌を伴う場合、しばしば片側副腎摘出あるいは両側副腎摘出術を要する場合があります。しかしながら両側副腎は腫大しますが、癌ではなく過形成であり、副腎摘出に代わる内科治療が望まれています。副腎皮質に存在する受容体異常に対応した受容体拮抗薬の臨床応用が期待されましたが、有効な結果が得られていないのが現状です。ARMC5遺伝子異常はPMAHの50%以上と高い頻度で認められ、その制御メカニズムを解明することで、新たな分子標的薬の開発、患者さんの生命予後の改善・QOLの改善へとつながることが期待できます。
横手 幸太郎(千葉大学大学院医学研究院 内分泌代謝・血液・老年内科学 教授)
鈴木先生は、日常診療の中から生じた疑問を解決すべく、基礎研究・臨床研究の手法を駆使してこれに取り組んでいます。グルタミン代謝を通じた生活習慣病とがんへのアプローチや副腎皮質病変PMAHの病因解析の成果は、内分泌学会や糖尿病学会をはじめ様々な領域で高い評価を得ています。そして何より、自然にご家庭と両立してこれらの仕事を展開されている姿は、内科学におけるダイバーシティのロールモデルだと思います。