血中の酵素が遺伝的に欠損もしくは機能低下することで発症する難治性の疾患が数多く知られています。これらの疾患には欠損した酵素を体内に補充することで治療が可能であると考えられますが、希少疾患であることが多く、その多くは治療法が確立されていません。私たちは臨床で移植治療によく使用されている脂肪細胞の優れた特性に着目し、これに欠損酵素の遺伝子を導入し、これらの酵素を分泌する細胞を作り出し、患者さんの体内に戻すことで、持続的に欠損酵素を体内で補充できる治療法の開発研究を行っています。
研究活動
黒田 正幸
Masayuki Kuroda, PhD. |
|---|
 |
- E-mail
- kurodam(ここにアットマーク)faculty.chiba-u.jp
- TEL
- +81-43-226-2092
- FAX:
- +81-43-226-2095
|
主な研究テーマ
- 脂肪細胞を用いた酵素・蛋白補充療法のトランスレーショナルリサーチ
- Ex vivo遺伝子細胞治療用レトロ、レンチウイルスベクター開発
- 脂肪細胞、脂肪幹細胞(脂肪組織)による病態修飾機構の解明
研究の概要
血液中の酵素・蛋白を欠いているために重篤な症状を示す疾患が数多く知られています。これらの疾患では体内の様々な臓器に障害が生じ、患者さんの生命予後に重大な影響を及ぼします。
脂肪細胞は組織欠損の修復など、臨床的に優れた移植細胞であることが知られています。脂肪細胞が長寿命であること、がん化しにくいことなどが明らかになるにつれてその重要性は増しています。またエネルギーを貯蔵する機能だけでなく、多数の機能性タンパク質を分泌し、全身代謝を制御していることが知られています。近年の再生細胞医療研究からも、脂肪組織は自家移植治療用の前駆細胞調製に有用な生体組織であることが分かってきました。
本研究室ではこれまでメタボリックシンドロームの病態解析を通じて、モデル動物を用いた脂肪細胞移植研究を進めてきました。私たちの研究グループは、この研究成果・知見に基づき、難病を治療するためのタンパク質を分泌するよう加工した脂肪細胞を用いた遺伝子細胞治療法の実用化研究を進めています。
家族性LCAT欠損症を対象としたヒト前脂肪細胞用いた新たな治療法の開発
血液中の酵素・蛋白を欠いているために重篤な症状を示す疾患の一つとして家族性レシチン:コレステロールアシルトランスフェラーゼ(LCAT)欠損症が知られています。この疾患は本科が診療対象とする難治性脂質異常症の一つで、LCAT酵素の遺伝子異常による善玉コレステロール(HDL)の機能異常をきたし、HDLがゼロもしくは著明に低くなり体内のコレステロールを正常に処理できなくなるため、結果として、角膜混濁や重篤な腎機能障害をきたす先天性疾患です。この疾患は比較的まれな遺伝疾患であり、治療法が確立されていない難病です。
平成25年5月、この疾患を対象とした遺伝子治療臨床研究(課題名『家族性LCAT欠損症を対象としたLCAT遺伝子導入ヒト前脂肪細胞の自家移植に関する臨床研究』、総括責任者:横手幸太郎)が千葉大学医学部附属病院を実施施設として厚生労働省より承認を受けました。(未来開拓センター)
この脂肪細胞加工技術は糖尿病、血友病、ライソゾーム病など多様な疾患の治療技術に応用できるものであり、形成外科教室や本教室の他の先生方と協力して、家族性LCAT欠損症に続いて、可能な限り多くの疾患治療技術を開発していく予定です。
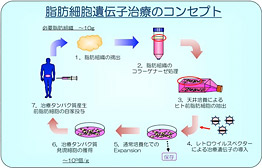
図:腹部皮下から吸引摘出した脂肪細胞に補充蛋白遺伝子を導入して自己移植することで欠損蛋白を安定長期に補充する遺伝子細胞治療法を開発しています
参考論文
- Naito S, Kamata M, Furuya M, Hayashi M, Kuroda M, Bujo H, Kamata K. (2013) Amelioration of circulating lipoprotein profile and proteinuria in a patient with LCAT deficiency due to a novel mutation (Cys74Tyr) in the lid region of LCAT under a fat-restricted diet and ARB treatment. Atherosclerosis. 228, 193-197
- Fukaya Y, Kuroda M, Aoyagi Y, Asada S, Kubota Y, Okamoto Y, Nakayama T, Saito Y, Satoh K, Bujo H. (2012) Platelet-rich plasma inhibits the apoptosis of highly adipogenic homogeneous preadipocytes in an in vitro culture system. Exp. Mol. Med. 44, 330-339.
- Aoyagi Y, Kuroda M, Asada S, Tanaka S, Konno S, Tanio M, Aso M, Okamoto Y, Nakayama T, Saito Y, Bujo H. (2012) Fibrin glue is a candidate scaffold for long-term therapeutic protein expression in spontaneously differentiated adipocytes in vitro. Exp Cell Res. 318, 8-15.
- Kuroda M, Bujo H, Aso M, Saito Y. Adipocytes as a vehicle for ex vivo gene therapy: Novel replacement therapy for diabetes and other metabolic diseases. (2011) J Diabet Invest. 2, 333-340.
- Asada S, Kuroda M, Aoyagi Y, Fukaya Y, Tanaka S, Konno S, Tanio M, Aso M, Satoh K, Okamoto Y, Nakayama T, Saito Y, Bujo H. (2011) Ceiling culture-derived proliferative adipocytes retain high adipogenic potential suitable for use as a vehicle for gene transduction therapy. Am J Physiol Cell Physiol. 301, C181-C185.
- Aoyagi Y, Asada S, Kuroda M, Bujo H, Tanaka S, Konno S, Tanio M, Ishii I, Aso M, Saito Y. (2011) Fibrin glue increases the cell survival and the transduced gene product secretion of the ceiling culture-devived adipocytes transplanted in mice. Exp Mol Med. 43, 161-167.
- Kuroda M, Aoyagi Y, Asada S, Bujo H, Tanaka S, Konno S, Tanio M, Ishii I, Machida K, Matsumoto F, Satoh K, Aso M, Saito Y. (2011) Ceiling culture-derived proliferative adipocytes are a possible delivery vehicle in enzyme replacement therapy in lecithin:cholesterol acyltransferase deficiency. The Open Gene Ther. J. 4, 1-10.
- Asada S, Kuroda M, Aoyagi Y, Bujo H, Tanaka S, Konno S, Tanio M, Ishii I, Aso M, Saito Y. (2011) Disturbed apolipoprotein A-I-containing lipoproteins in fish-eye disease are improved by the lecithin:cholesterol acyltransferase produced by gene-transduced adipocytes in vitro. Mol Genet Metab. 102, 229-231.