研究分野の概要
エピゲノムとはゲノムDNA塩基配列そのものではなくその修飾要素として細胞分裂の際に娘細胞に維持・伝達される情報のことで、発生・分化において遺伝子発現の制御に重要な役割を果たします。ゲノムDNA塩基配列中のCpG配列におけるシトシン(C)のメチル化は、代表的なエピゲノム情報です。ゲノムDNAは細胞核内にクロマチン構造として折り畳まれて収納されています。クロマチンの基本単位であるヌクレオソームは、147塩基対のDNAがヒストン8量体の周囲に1.75回巻きついた構造をしています。このヒストンのN末端はヒストンテールと呼ばれ、アセチル化やメチル化など様々な修飾を受けて転写制御に大きく関わることが知られます。これらヒストン修飾も代表的なエピゲノム情報です。こうした修飾を受けたゲノムは、不活性な状態で使われずに折りたたまれているヘテロクロマチンや、活性化したユークロマチンに分かれ、そこでは活性化した遺伝子のプロモーターやエンハンサーが3次元的に近接しています。このようなクロマチン3次元構造もエピゲノム研究の対象です。正常な細胞ではエピゲノムによる緻密な遺伝子発現制御が行われており、その異常は癌の発生・進展に深く関与します。その研究が、私どもの進める癌エピゲノム研究です。
臨床標本のエピゲノム網羅的解析による疾患本態解明
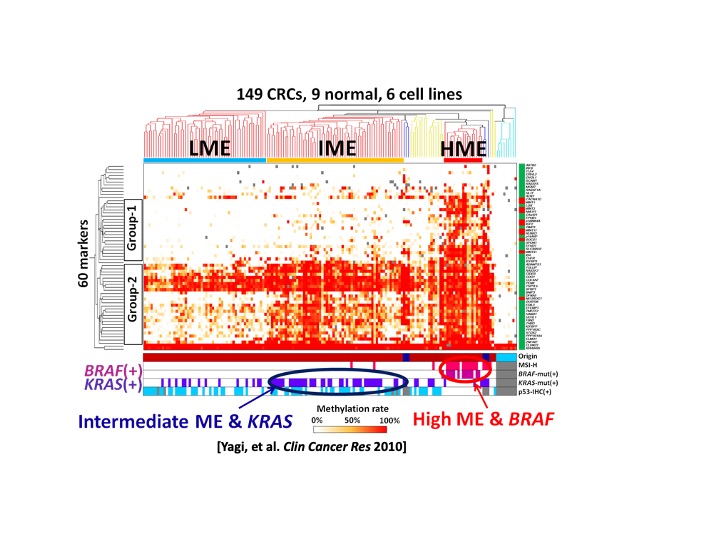
大腸癌標本に対し網羅的なDNAメチル化情報を取得し階層的クラスタリング解析を行うと、高・中・低メチル化群の3つの分子サブタイプに分かれます(図1)。高メチル化群は癌遺伝子BRAF変異(+)と、中メチル化群はKRAS変異(+)と相関し、低メチル化群はBRAF変異(-) KRAS変異(-)と相関します。中メチル化・KRAS変異(+)症例は予後不良な大腸癌です。網羅的解析の黎明期のこれらの成果は、大腸に発生母地や発生要因の異なる3群以上のユニークな癌が存在することを提唱し、この結果の確かさは他施設の研究でも確認され、またメチル化以外のゲノム網羅的情報を用いて大腸癌を4群に分類する際にも包含されています。
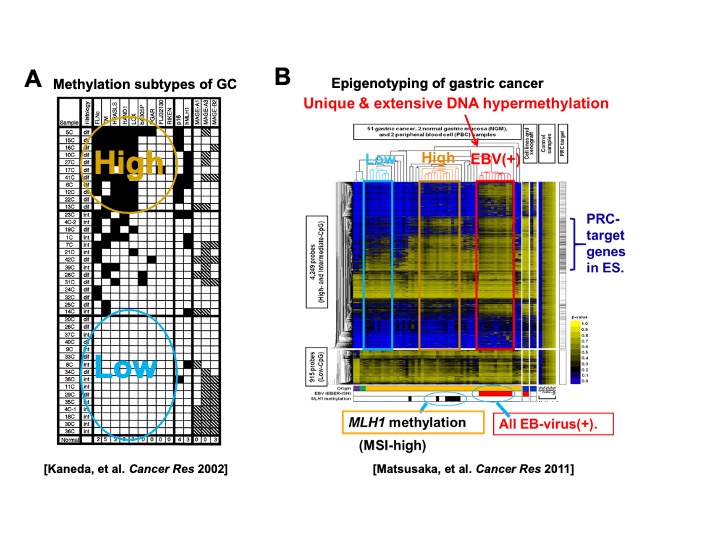
胃癌標本についても、制限酵素を用いた限定的なゲノム解析を行っていた黎明期から、胃癌のDNAメチル化標的遺伝子の大量同定に初めて成功し胃癌新規癌抑制遺伝子を同定しました(図2A)。アレイを用いたより網羅的なメチル化解析による階層的クラスタリングもいち早く成功し、胃癌の7-15%を占めるEpstein-Barrウイルス(EBV)陽性胃癌が超高メチル化を呈する独立した胃癌分子サブタイプであることを発見しました(図2B)。EBV感染が、この分子サブタイプに見られる高度なエピゲノム異常を引き起こす原因となっており、すなわち発癌要因となっている証明研究は後述します。
疾患・環境モデルとNGSを駆使した高次元エピゲノム現象の解明
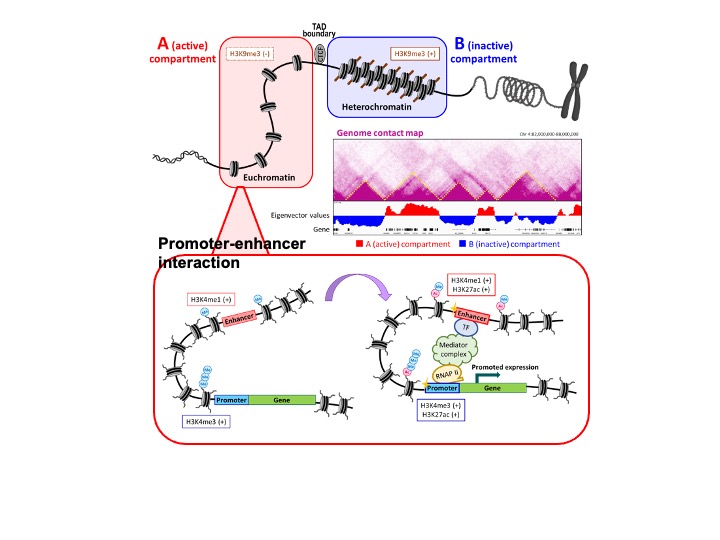
次世代シーケンサー(NGS)やアレイを駆使して、例えばゲノムDNAの修飾であるDNAメチル化、ヒストンの活性化マーク(H3K4me1、H3K4me3、H3K36me3、H3K27ac、etc)や不活化マーク(H3K9me3、H3K27me3、etc)、クロマチンアクセシビリティ(FAIRE、ATAC、MNase、etc)、インシュレーター(CTCF)、転写因子やクロマチンリモデリング因子などの蛋白結合、などの状態を網羅的に取得します。これらはゲノムDNAに沿った1次元的な修飾情報ですが、Hi-Cや4C-seqなどゲノム近接関係を解析する手法により3次元的なゲノム構造も解析します(図3)。
さらに病原体感染、低酸素、低栄養、癌治療、など癌の発症・進展に関連する環境を模したin vitro/in vivoモデルを用い、時系列を含めた4次元的なエピゲノム変化を解明します。
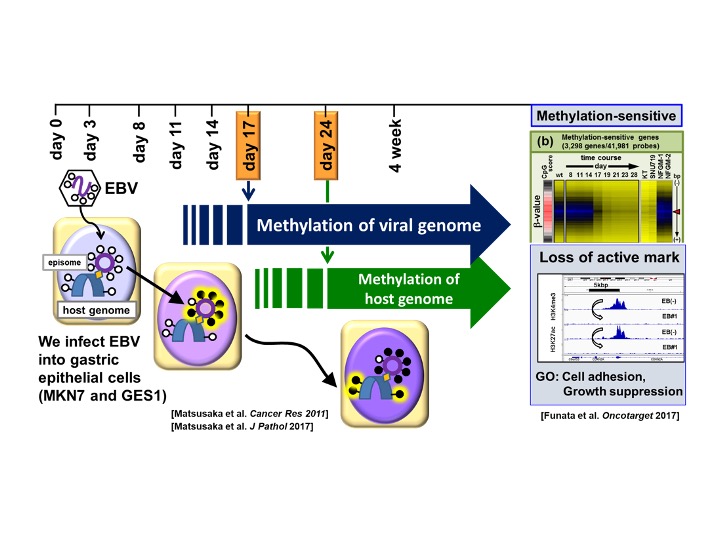
例えば独立した胃癌サブタイプと証明したEBV胃癌については、胃上皮細胞へのin vitro EBV感染モデルを用いた詳細な解析により、EBV感染が4週以内に3000以上の遺伝子プロモーター領域にDNAメチル化を誘導することを証明しました(図4)。EBVは実在する疾患の高度なDNAメチル化や遺伝子不活化を生理的モデルで100%の再現性で証明できた、世界でも唯一のエピ変異原と思われます。
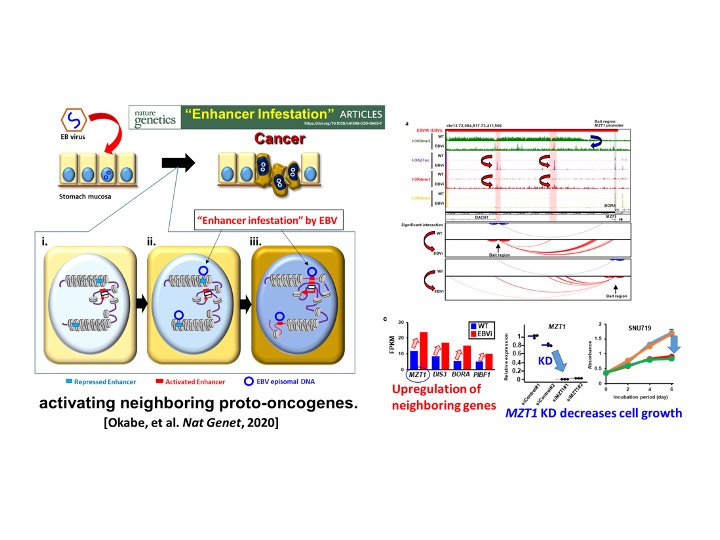
DNAメチル化による不活化だけでなく、EBVは不活化領域であるヘテロクロマチンに結合することでその領域を異常活性化し、周囲に存在する癌原遺伝子を発現亢進させることを詳細な4次元エピゲノム解析により証明しました。「エンハンサー侵襲(Enhancer Infestation)」と名付けた、全く新たなエピゲノム発癌機構です(図5)。
エピゲノム関連因子の機能解析による生命現象の本態解明
エピゲノムの活性化マークや不活化マークを書き込む酵素(メチル化酵素、アセチル化酵素、etc)や消去する酵素(脱メチル化酵素、脱アセチル化酵素、etc)、それらを含有する複合体、などに対し詳細な機能解析を行い生命現象の本態を解明しています。
例えばDNAメチル化に対する脱メチル化作用で知られるTET2は、EBV感染によりEBV因子やmiRNA発現などを介して発現低下し、異常なDNA高メチル化の獲得に関与しています。
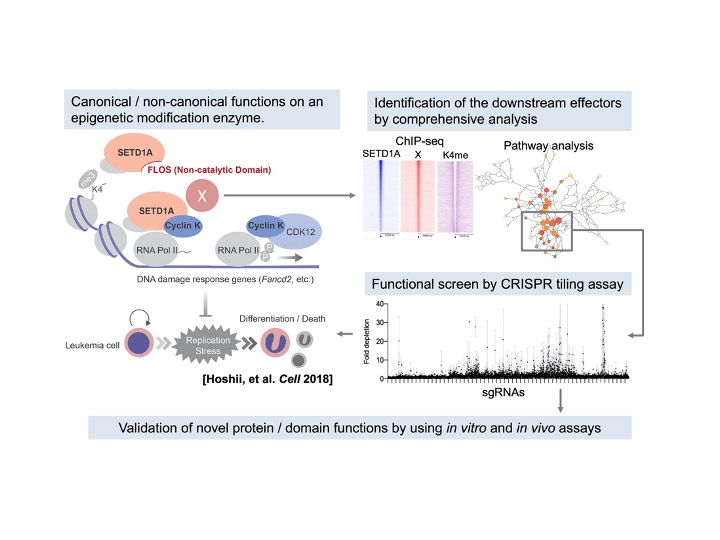
ヒストンH3K4のメチル化酵素であるKMT2ファミリー分子(MLL1-4, SETD1A/B)は染色体再構成や欠失に伴い、白血病の原因になることが知られています。近年ではMLLファミリー分子の一つであるSETD1Aが白血病細胞の生存に必須であることを同定し、酵素機能とは独立した転写制御作用を持つことを発見しました。さらにSETD1Aの働きは細胞周期と密接に関連し、がんのゲノム安定性の維持に必要であることが分かってきました。このような特徴的な働きを標的とすることによって、新しいがんの治療標的の創出に結びつくことが期待されます。現在では、メチル化を担う酵素活性ドメインやそれ以外のドメインによる作用、新規結合蛋白の役割をPROTAC技術やCRISPR-Cas9技術を活用して詳細に解析し、遺伝子発現制御や発癌への関与を研究するプロジェクトも進んでいます(図6)。
エピゲノム異常の蓄積による疾患発症リスク研究
エピゲノム異常は癌発症・進展に関与しますが、正常組織に少しずつ蓄積したエピゲノム異常は癌の発症リスクを上昇させます。一見正常に見えますが、増殖性の高いより未分化な状態の細胞になっており癌の発生母地を形成すると考えられます。
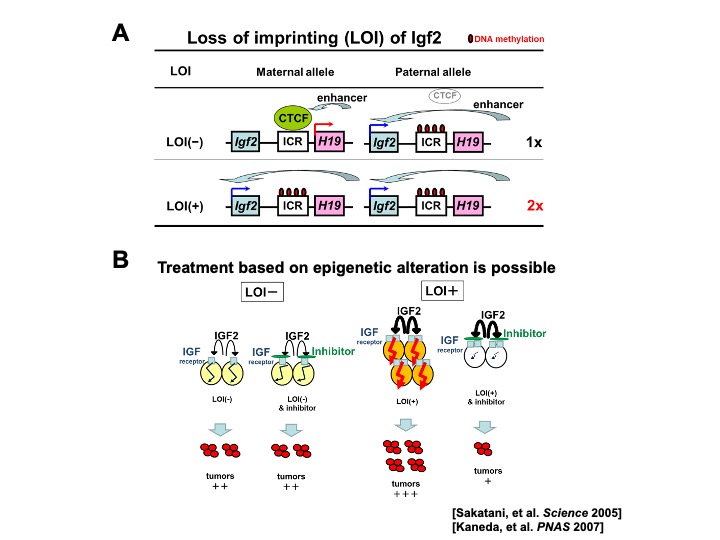
この概念はインプリンティング遺伝子IGF2のエピゲノム異常をモデルに用いて初めて証明されました。ふだん父方アリルのみ発現しているIGF2遺伝子が、両方のアリルから発現するエピゲノム異常であるゲノムインプリンティング消失(loss of imprinting, LOI)により、通常の2倍量発現します(図7A)。LOI陽性だと、細胞増殖がIGF2刺激に鋭敏かつ依存的になっており、腸管上皮前駆細胞がより未分化となり数も多い状態となるために腸管腫瘍リスクが高くなります。その特性に対してIGF受容体阻害剤を投与しIGF2シグナルを阻害すると、LOI(-)のふつうのマウスでは変化はなく、LOI(+)マウスでのみ、発癌剤による前癌病変の発生数が劇的に減少します(図7B)。一見正常に見える組織ですでに蓄積したエピゲノム異常が、単にリスクマーカーになるだけでなく原因として発癌リスクに関わり、治療標的にし得ることを示しました。
今後、様々な臓器で、蓄積するエピゲノム異常とその後に発症する疾患リスクについて解明します。