研究・業績

千葉大学大学院医学研究院
皮膚科学
千葉大学病院
皮膚科

ノーベル賞を取った免疫チェックポイント阻害薬や、最近注目が集まっている腫瘍浸潤リンパ球(TIL)療法は、がん免疫療法の代表的な成功例です。メラノーマという皮膚がんにもっともよく効くため、メラノーマを対象とした研究によって開発が進められてきました。したがって、現状のがん免疫療法全般の課題を解決してゆくためには、実際に治療を受けたメラノーマの患者さんの体内、病巣内で起きていることを、詳細に調べることが重要と考え、研究を行っています。私たちは、以下に記載するいくつかの視点から、がん免疫療法の効果を高め、効率化するための方策を探っています。
図1:がん細胞は免疫によって攻撃を受けると、それをすり抜けるような機構を作動させて逃れることが知られています。これをがん免疫逃避と呼びます。私たちは、未知のがん免疫逃避機構を明らかにし、それへの対応策を発見する研究を行っています。
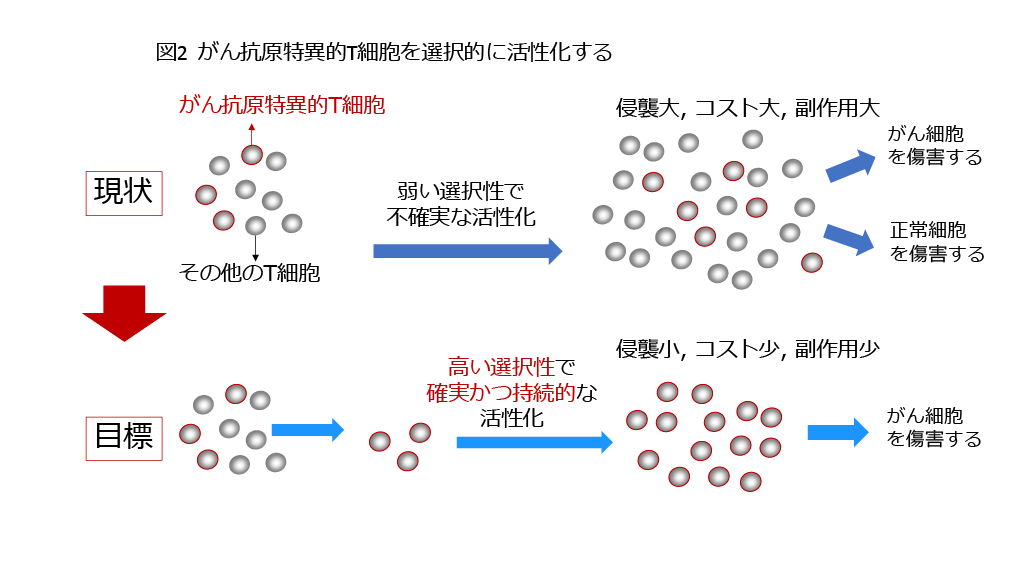
図2:現状のがん免疫療法は、がん細胞を認識して攻撃できるT細胞(がん抗原特異的T細胞)を活性化してがんを破壊させることを目的としていますが、それ以外の、例えば健康な人体組織を攻撃してしまうような害となるT細胞も同時に活性化してしまうことがあります。私たちは活性化させたいT細胞と活性化させたくないT細胞を見分ける目印を見つけ、また活性化させたいT細胞だけを強く長く活性化させる方法を開発するための研究を行っています。
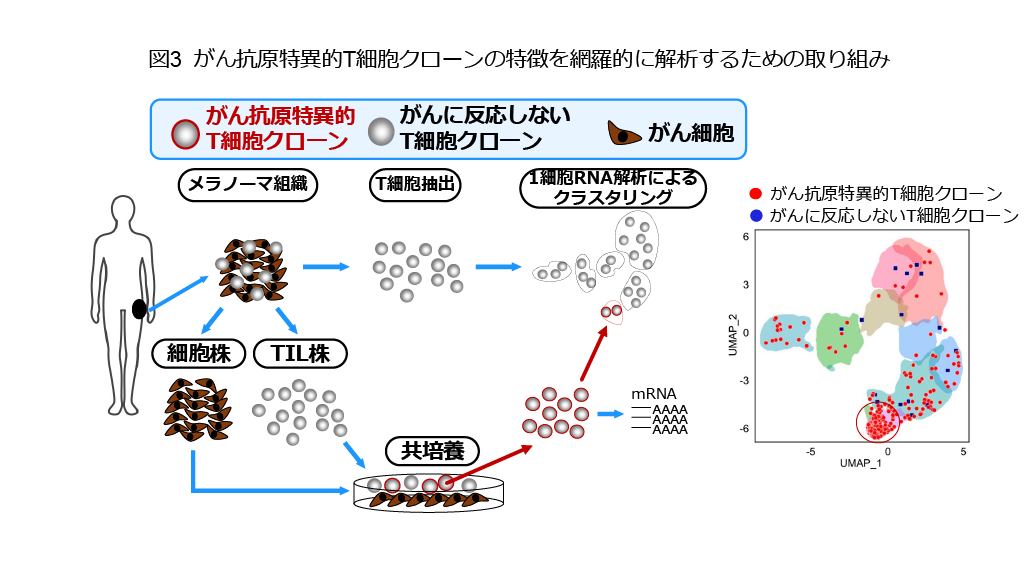
図3:体内の多種多様なT細胞の中から、がん抗原特異的T細胞を正確に見つけて、その特徴を網羅的に明らかにすることが重要と考えています。1細胞RNA解析という最新技術と、がん抗原特異的T細胞を正確に捉えて増殖させる試験管内の技術を融合して、がん抗原特異的T細胞の網羅的な特徴を解明しています。
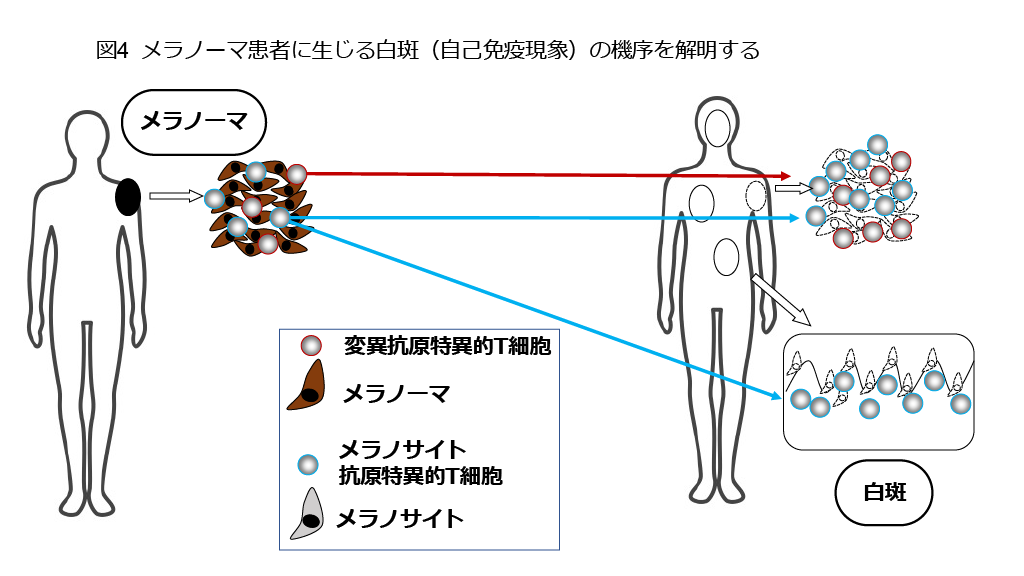
図4:メラノーマ患者に対してがん免疫療法を行うと、白斑という自己免疫現象が起きることがあります。活性化されたT細胞の一部が、皮膚に存在するメラノサイト(メラニン色素を作る正常細胞)を破壊するためです。私たちは、白斑においてメラノサイトを攻撃しているT細胞を正確に捉えて解析し、白斑をはじめとする自己免疫現象を抑制する方法を開発するための研究を行っています。
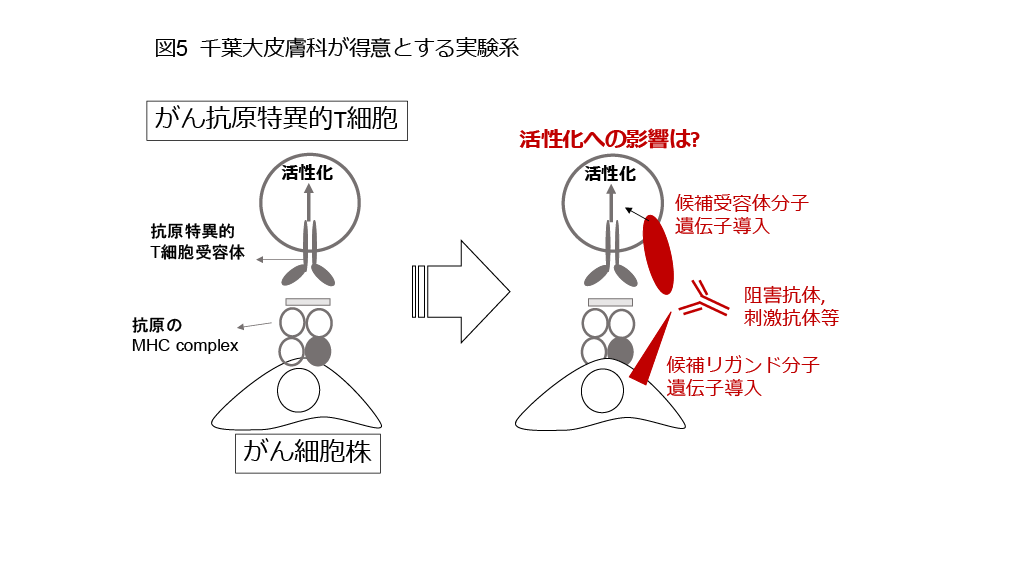
図5:私たちの研究室の強みは、多くの患者さんから頂いたがん特異的T細胞とがん細胞株のペアを大事に維持、保存しており、それらを使って正確で再現性の高い非動物モデルの実験ができることです。遺伝子操作や薬剤添加によって、がん抗原特異的T細胞の攻撃力を増加させたり、がん細胞の免疫逃避機構を克服したりするための方法を開発しようとしています。