肺高血圧症

千葉大学大学院医学研究院
呼吸器内科学
千葉大学病院
呼吸器内科

慢性血栓塞栓性肺高血圧症 (Chronic thromboembolic pulmonary hypertension : CTEPH)
(医療従事者向け) 2014年7月
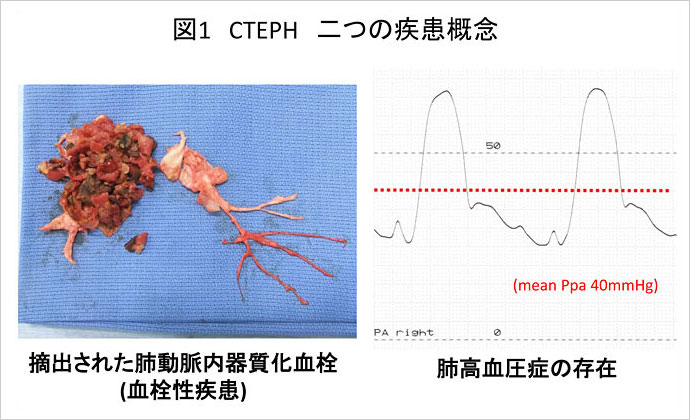
慢性血栓塞栓性肺高血圧症(CTEPH)は肺動脈内に発生する器質化血栓による肺動脈の閉塞とそれに伴う肺高血圧症を特徴する疾患である(1). CTEPHには「血栓性疾患」「肺循環疾患(肺高血圧症)」と二つの疾患概念が併存することが大きな特徴である(図1).
「血栓性疾患」としては器質化した血栓により肺動脈が慢性的に閉塞をおこした疾患の総称であり, 肺高血圧症を伴わない場合は慢性肺血栓塞栓症(Chronic pulmonary thromboembolism: CPTE)と呼ばれる. 「慢性的に肺動脈内に血栓が存在する」とは, 『6カ月以上にわたって肺血流分布が大きく変化しない(6ヶ月以上肺動脈内の血栓が残存する)こと』とする基準が定義として用いられることが多い.
「肺高血圧症」としては, 慢性安定期の肺動脈平均圧が25mmHg以上であり, かつ肺動脈楔入圧が12mmHg以下であることが必要条件とされる.
以上の二つの概念を満たす疾患がCTEPHであるとされ, 後述する「厚生労働省特定疾患呼吸不全調査研究班によるCTEPH認定基準」もこれらを確認する内容となっている.
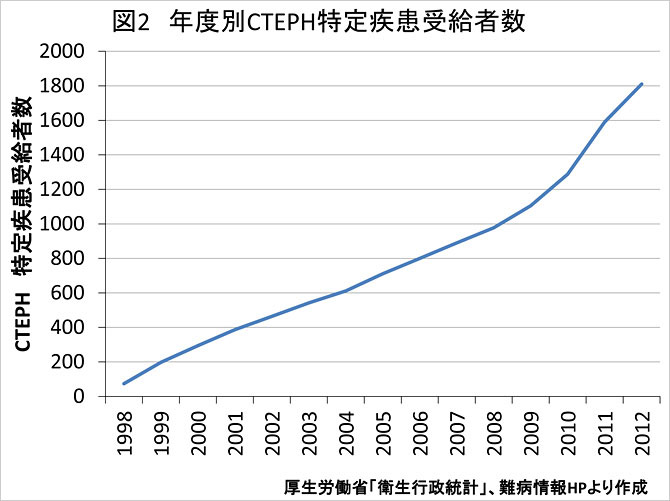
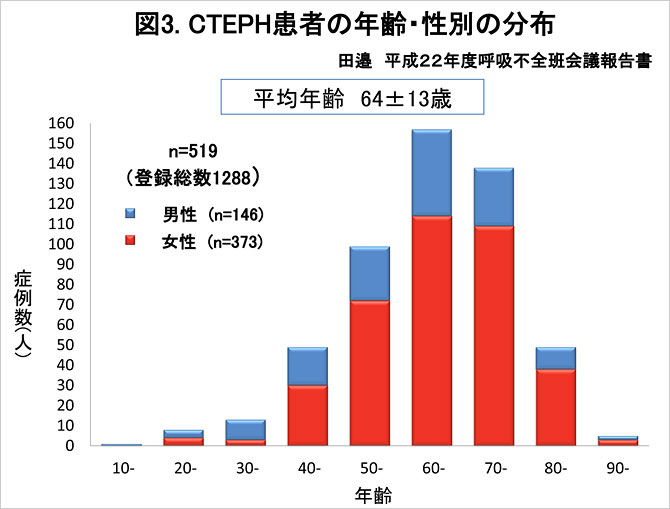
我が国において, 急性例および慢性例を含めた肺血栓塞栓症の発生頻度は, 欧米に比べ極めて少なく, 剖検輯報にみる病理解剖を基礎とした検討でも, その発生率は米国の約1/10とされている. 厚生労働省特定疾患受給者数統計によると本邦におけるでは2012年度 CTEPH患者数は1,810名であり, 年々増加傾向である (図2). 本邦症例は女性に多いこと(1:2.8 (2012年度))などいくつかの傾向が海外報告例と異なり, CTEPHの病型に人種差が存在する可能性が指摘されている (1,2). 発生機序として深部静脈血栓症とそれに伴う急性肺血栓塞栓症の先行が想定されるが, 本邦での合併率はそれぞれ50.4%, 37.2%程度とされる(1). 急性肺血栓塞栓症からの慢性化率は諸説あるが0.1-4%程度とされる(1)
慢性肺血栓症は臨床経過により以下の3つに大別される
1の本態は「急性肺血栓塞栓症の反復」である. こうした病態では反復発作の度に血栓溶解が十分行われれば, 臨床症状や肺循環動態ともほぼ正常まで回復することも多い. しかしながら, 一部の症例では血栓溶解が不十分なため, 残存血栓の蓄積 から3の肺高血圧症を合併したCPTEへ移行することもあり注意が必要である.
2のような急性例からの血栓残存例は慢性肺血栓症(Chronic pulmonary thromboembolism: CPTE)と呼ばれる。肺動脈内に残存する血栓は線維に富んだ器質化血栓であり, 急性肺血栓症のそれとは根本的に異なる. 多くの場合, こうした器質化血栓による閉塞をきたした肺血管床が広範囲でない限り, 正常肺のもつ豊富な予備血管床の動員により肺動脈圧上昇が緩衝されるため, 肺高血圧症の合併を含め臨床症状をきたすことは稀といえる.
臨床的に特に重要なのは, 3の慢性血栓塞栓性肺高血圧症である. 1の慢性反復型と考えられる症例のほか, 明らかな血栓反復の無いまま病状の進行がみられる, いわゆる潜伏型と考えられる症例もしばしば認められる. 慢性血栓塞栓性肺高血圧症は予後を含めて臨床的に重篤な疾患であるばかりでなく, 外科的治療が可能であることからも, その診断は極めて重要といえる.
本症の正確な発症機序は未だ明らかとはいえない. 前述のごとく深部静脈血栓症に起因する急性肺動脈内血栓が肺動脈壁との相互作用の中で肺動脈リモデリングを促し, その結果肺高血圧症をきたす説がある(Semin Thorac Cardiovasc Surg 2006;18:265). しかし発症年齢の分布が急性例に比し若年であり発生頻度として慢性例の頻度が高いこと, 深部静脈血栓の合併頻度はあまり高くないことなどから急性肺血栓塞栓症とは全く別の疾患である可能性も示唆されている.
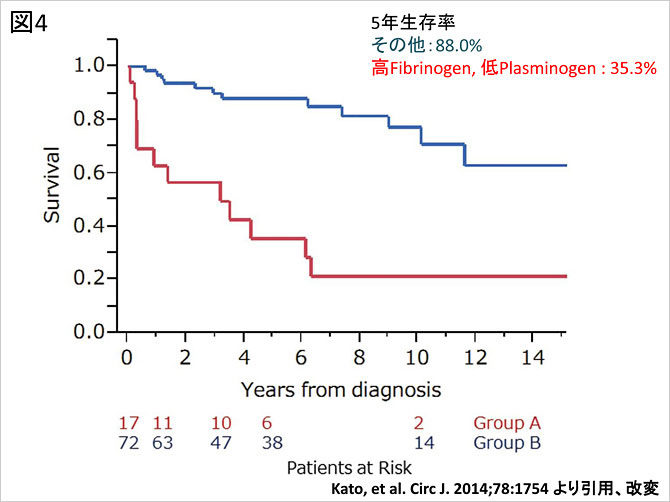
「血栓性疾患」の側面として血液凝固系の異常の関与が考えられる.アンチトロンビンIII, プロテインCおよびSの各欠乏症や抗リン脂質抗体症候群などとの関連も示唆され, 病態発生との関連が注目されている. 当グループではフィブリノーゲン高値でプラスミノーゲン低値を示す患者では薬物治療に対する予後が不良であることを示し(3), こうした凝固系異常が薬物治療の効果に影響を及ぼすとともにCTEPHの病態そのものに関与することを報告した(図4).
「肺循環障害」の側面として, CTEPHの肺末梢部分には肺動脈性肺高血圧症に類似した肺動脈リモデリング所見が認められ(Moser KM, et al. Chest 1993), CTEPHにおいて肺高血圧に至る病態に強く関与していると考えられている(Galie N, et al. Proc Am Thorac Soc 2006).
さらに性別を含めた様々なレベルの遺伝子レベルの因子の関与が示唆されている. 本邦CTEPH症例では海外と比較しHLA-B*5201陽性率が高いことを示し (2), 同遺伝子の有無や性別によって深部静脈血栓症合併率などの臨床的な特徴が異なることについて報告した(4,5). またG蛋白βサブユニットの遺伝子多型によって肺血管拡張薬に対する反応性が異なるなど, 遺伝子多型と治療反応性との関連も示唆されている(6).
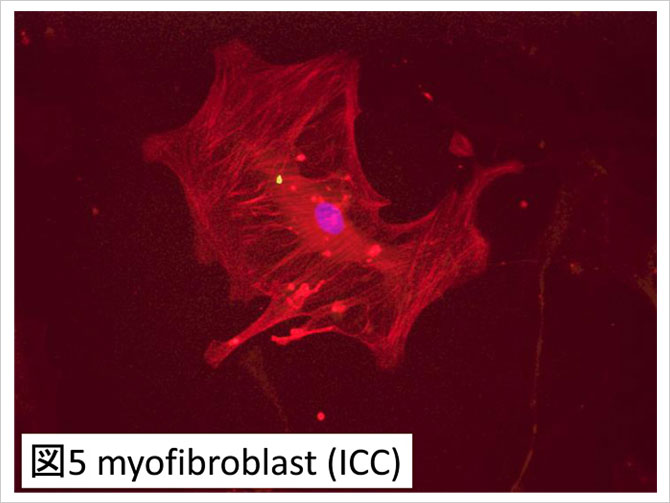
基礎研究レベルではCTEPH器質化血栓から培養された筋線維芽細胞(図5)が内皮細胞との相互作用を介してCTEPH慢性化に関与している可能性が指摘されている(7,8).
CTEPHはシンプルな「血栓性疾患」ではなく様々な病態が複雑に関連している可能性が高く, 病態解明を目指した更なる検討が必要である.
自覚症状として本症に特異的なものはなく, 他の心肺疾患においても認められる症状がほとんどといえる. 労作時呼吸困難は最も高頻度にみられ, 受診時の主訴としては最も多い. 急性肺血栓症を繰り返す症例では, 急性肺血栓塞栓症に類似した突然の呼吸困難や胸痛を主訴とすることが多い(図6). 一方, 反復の明確ではない潜伏型では徐々に労作時呼吸困難が増強してくる. このほか, 胸痛, 咳嗽, 失神などもみられ, 特に肺出血や肺梗塞を合併すると, 血痰や発熱をきたすこともある. 肺高血圧の合併により右心不全症状をきたすと, 腹部膨満感や体重増加, 下腿浮腫などがみられる.

理学所見としては, 低酸素血症の進行に伴いチアノーゼ, および過呼吸, 頻脈がみられる. 下肢の深部静脈血栓症を合併する症例では, 下肢の腫脹や疼痛が認められる. また, 右心不全症状を合併すると, 肝腫大および季肋部の圧痛, 下腿浮腫なども認められるようになる.
聴診所見では肺高血圧の進展に伴い, II音肺動脈成分の亢進および三尖弁逆流による収縮期心雑音が聴取されることが多い。また比較的中枢側の肺動脈が, 付着血栓により狭窄をきたすと, 同部の肺野で収縮期肺血管雑音を聴取することがあり, 肺動脈性肺高血圧症との鑑別に有用とされる.
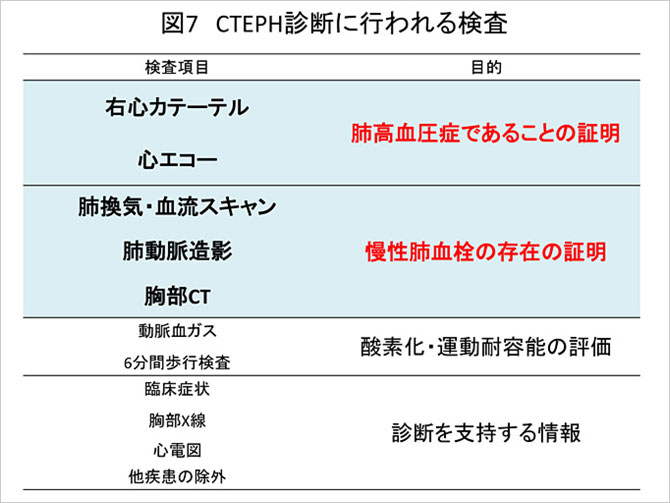
CTEPHの診断は「慢性肺血栓」および「肺高血圧症」の二つの要素が存在する事を証明することが診断のポイントになる(図7).
特異的所見はなく, 診断的価値は乏しい. 血小板減少, CRP陽性, LDH 上昇, 総ビリルビン値上昇などに加え, Fibrinogen増加, FDPおよびD-Dimer増加をきたす場合もある. また, 右心不全から肝うっ血をきたすと, GOT, GPT上昇などの肝機能障害を示す.
動脈血液ガス分析では, PaO2, PaCO2ともに低下し, AaDO2が開大を示すことが大きな特徴の一つともいえる. 一方, 肺機能検査所見では, 多くの場合正常値を示すが, 約20%の症例では, 続発する肺梗塞や胸膜病変のため拘束性換気障害を示すとされる. また肺拡散能も, 血栓の閉塞により肺血管床が大きく低下しない限り正常のことが多い.
心電図では, 肺高血圧の進展に伴い, 右軸偏位や肺性P波, 胸部誘導V1からV3にかけての陰性T波出現, V1誘導での R/S>1, V5誘導でのR/S<1などといった, 右室肥大および右心負荷所見が観察される. また, 心エコーでは, 右室の拡大および肥大に加え, 心室中隔の左室側への圧排や奇異性運動などが認められる. さらに, ドップラー法を用いることで肺動脈圧の推定が可能であり, 肺高血圧症の存在が疑われる契機となる事も少なくない.
胸部単純X線写真では, 閉塞側の肺血管陰影の減弱(Westermark sign), および対側への血流増加などといった, 肺血管陰影に局所差が認められることが特徴とされるが, ほとんど異常が認められないことも多く注意が必要である. また, 肺出血や肺梗塞を合併すると, 肺野に浸潤影・索状影に加え, 胸水の貯留なども認められる. 肺高血圧を合併すると, 肺門部肺血管陰影の拡大や左第4弓の突出, 心陰影拡大などもみられる.
肺血流シンチグラフィ検査は,侵襲も少なく繰り返しての検査が可能である上, 肺血栓症の存在に対する特異度が極めて高い. 肺血栓症のスクリーニング検査として必須といえる. 慢性肺疾患などの換気障害に伴う血流障害を鑑別する意味でも, 可能な限り肺換気シンチグラフィ検査と併せて行うべきである. 一般に, 換気が保たれた肺領域に血流の欠損した領域が認められる(換気血流不均等). CTEPHでは肺区域枝以上のレベルの大きさで単発にまたは多発して認められる.
本法は, スクリーニング検査としては極めて有用であるが, 血栓により閉塞していた血管に一部再疎通 が生じると, 欠損像としては検出できない。また血流欠損の程度が重症度を必ずしも反映しない (Azarian R, et al. J Nucl Med. 1997). あくまで他検査と組み合わせた総合的な判断が必要である.
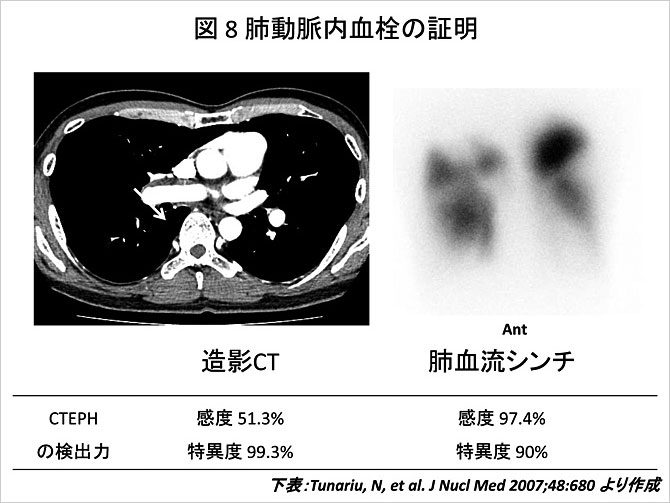
左右肺動脈主幹部などの中枢側に血栓が存在する場合, 胸部造影CTおよびMRIにより血栓の描出が可能である. 特に, MRIでは矢状断および前額断での観察も可能であり, 血栓付着部位の正確な把握に有用といえる. またCTでは, 肺出血や肺梗塞巣の性状や, 肺野濃度の比較から血流分布の把握がある程度可能なこともある. 最近のCT機器の進歩に伴い, 胸部造影Helical CTにて肺動脈区域枝レベルまでの血栓付着の有無が評価可能となり, 鑑別診断並びに外科的手術適応決定の際に有用とされる.
肺動脈造影は, 急性例・慢性例を問わず肺血栓塞栓症の診断において最も信頼のおける検査法といえる.
一般に慢性肺血栓塞栓症では, 急性例に認められるcut-off signやfilling defectsとは異なり,
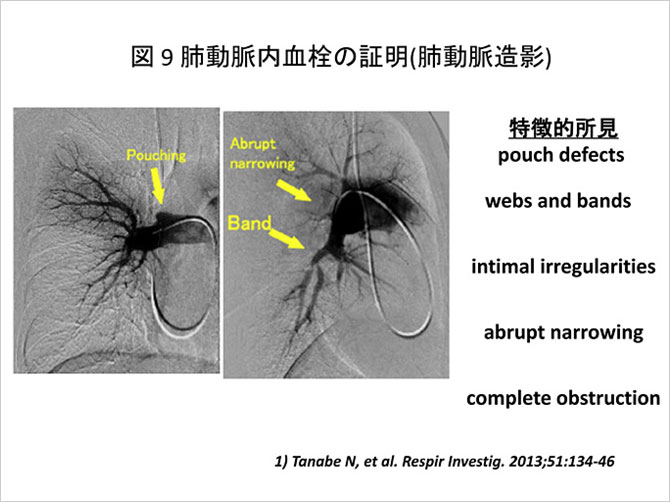
肺高血圧症の存在を示す必須の検査である. 前毛細血管性肺高血圧症の確認のため, 肺動脈平均圧が25mmHg以上であり, かつ肺毛細血管楔入圧が12mmHg以下 の正常値を示すことを確認する. また, 低酸素血症をきたすシャント性心疾患との鑑別 にも有用といえる. 肺動脈圧, 心拍出量の測定や混合静脈血酸素分圧の測定などから, 病態の正確な把握および重症度の評価が可能でもあり, 治療法を決定するうえでも必須の検査といえる.
一般に, 正常な右室心筋は左室に比べ薄く, その駆出圧には眼界があるため, 急性の変化のみでは肺動脈平均圧は40 mmHg以上にはなり得ないと考えられており, 従ってこれ以上を示す場合, 血栓塞栓の反復など慢性的な要素も十分考慮する必要がある.
慢性肺血栓塞栓症で著明な肺高血圧を伴う場合, 外科的治療法が可能であることからも肺動脈性肺高血圧症との鑑別は極めて重要である. 一般に肺動脈性肺高血圧との鑑別において (1)進行しない限り著明な低酸素血症をきたさないこと, (2)肺換気血流スキャンが正常もしくは亜区域枝レベルでの欠損像(patchy pattern)を示す, などがポイントとなる. 症例によっては鑑別が困難なこともあり,肺動脈造影による肺血栓塞栓症の除外が必要な場合もある.
大動脈炎症候群に伴う肺動脈炎と特発性のものが知られている. 肺血流スキャンでは, しばしば鑑別が困難であり, 血液検査での炎症所見の存在に加え, 肺動脈造影での狭窄像や閉塞像が主体であることが特徴といえる.
肺機能検査による換気障害の有無, 肺換気スキャンでの換気分布の評価, 胸部CTによる肺実質病変の有無などにより鑑別可能である.
血栓塞栓の反復が最近であれば(おおむね6週間以内), 新鮮血栓の溶解を期待して血栓溶解療法も考慮される. 一方、慢性例の多くは器質化した血栓によるものであり, 血栓溶解療法などの内科的治療法には限界がある. したがって器質化した血栓を内膜と外科的に剥離・摘出する肺血栓内膜摘除術が行われ, エビデンスが蓄積されている. 昨今, CTEPHに対し有力なカテーテル治療や薬物治療が開発され、治療のすそ野が広がってきている(図10).
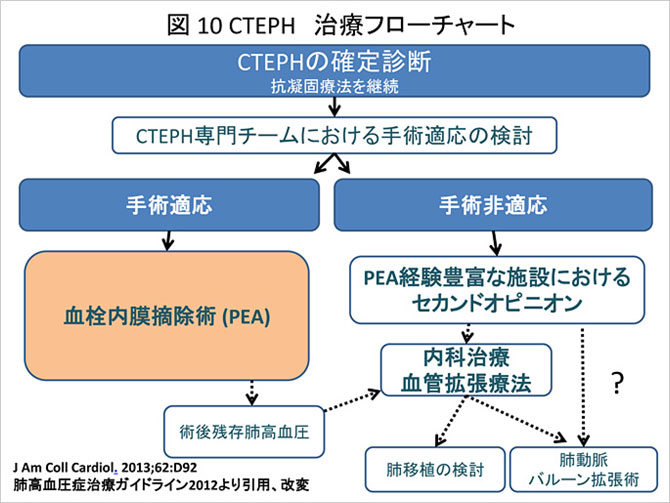
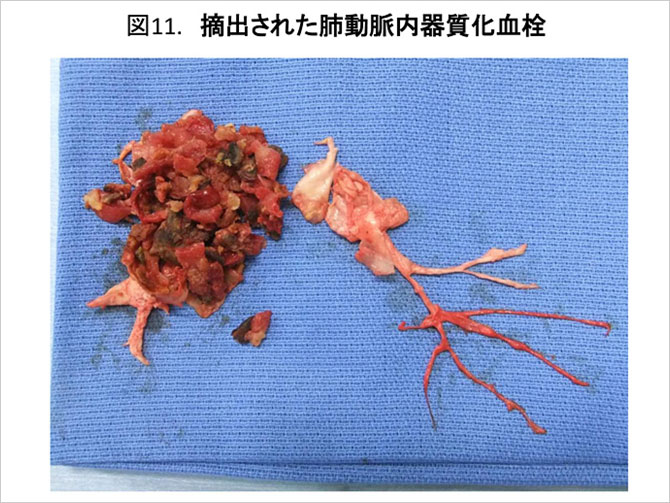
CTEPHに対し強いエビデンスが示されている外科的治療である. 当院千葉大学心臓血管外科ではおよそ1986年より130例以上の肺動脈血栓内膜摘除術(PEA)を継続的に施行してきた(図11) (9). 最近提唱されたCTEPH治療フローチャートでも手術可能症例では可能な限りPEAが勧められ, 一度非適応とされた症例でもPEAの経験豊富な施設にセカンドオピニオンを行い手術適応であるか再検討すべきであるとされている (J Am Coll Cardiol. 2013;62:D92).
千葉大学におけるPEAの適応基準は以下の通りである(図12) (1). 自覚症状が軽度(Hugh-Jones分類でII度以下, もしくはNYHA心機能分類でII度以下)器質化血栓が外科的に到達可能であり, 本疾患の他に重大な合併疾患がないことが必要条件である. 平均肺動脈圧が30 mmHg未満の症例でも自覚症状が強く, 肺高血圧の程度が強い場合には肺血栓内膜摘除術の適応を考慮する. 大手術であるが故、患者本人に対する十分な説明と手術に対する明確な希望は必須である.

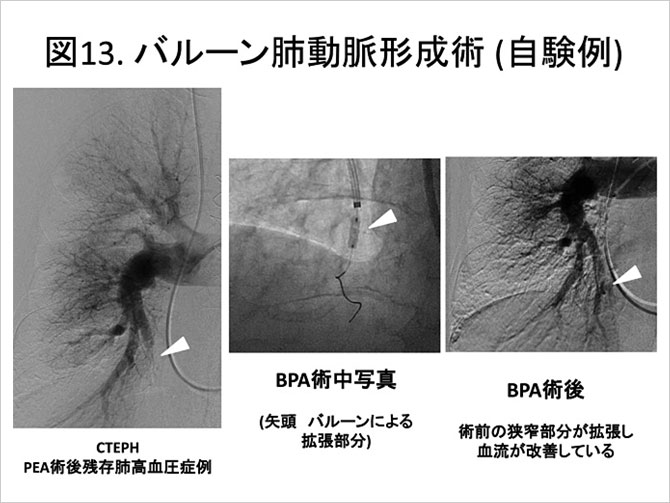
平均肺動脈圧など血行動態の改善が得られる事が知られていたが、 かつては再還流性肺水腫の発生率や人工呼吸管理の必要性が高く(Circulation. 2001;103:10). 安全性で血栓内膜摘除術に対する優位性が示せずなかなか普及しなかった。近年本邦の施設を中心に安全な管理方法が確立されつつあり(Circ Cardiovasc Interv. 2012;5:748, Circ Cardiovasc Interv. 2012;5:756), 有効性とPEAと比較した侵襲の低さのため爆発的に普及してきている(図13)。
手術適応例、カテーテル治療例に対しても酸素投与や抗凝固療法などの支持療法が必要である. いずれも支持療法としてのエビデンスレベルは高く、CTEPH患者に対しては特別な理由がない限り必須と言える.
低酸素性肺血管攣縮に対する効果や自覚症状の改善が期待できるため強く勧められる(肺高血圧症治療ガイドライン 2012年版).
急性肺血栓塞栓症の再発・新規発生の予防のため, CTEPH治療においては禁忌がない限り必須である. (肺高血圧症治療ガイドライン 2012年版)
血管拡張薬による内科治療も近年進歩が著しい. 本邦で広く使用されてきたベラプロストの他, ホスホジエステラーゼ-5 (PDE-5)阻害薬であるシルデナフィル, タダラフィル, エンドセリン受容体拮抗薬であるボセンタン, アンブリセンタン, 強い肺血管拡張作用のあるプロスタグランジンI2(PGI2)製剤であるエポプロステノール持続静注療法などの肺血管拡張薬が肺動脈性肺高血圧症に準じ使用されてきた.
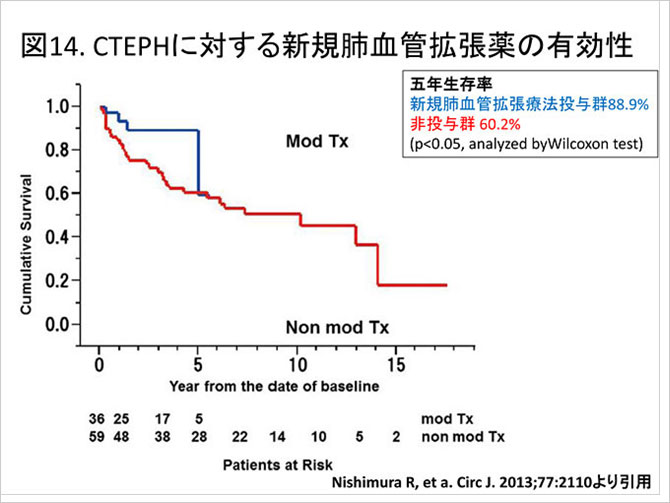
稀少疾患であるためこうした薬物治療に対するエビデンスが得られていなかったもの事実であった. 当科からシルデナフィルやボセンタンなど新規肺高血圧症治療薬が投与されたCTEPH患者群は非投与群と比べ予後が改善していることを示した(図14) (10).
近年, 可溶性グアニル酸シクラーゼ刺激薬であるリオシグアトのCTEPHに対する有効性が多施設ランダム化二重盲見試験で示された(N Engl J Med. 2013;369:319). 本邦でも「外科的治療不適応又は外科的治療後に残存・再発した慢性血栓塞栓性肺高血圧症」を適応症として既に保険収載されている.